��Ŀ����
��������ᶼ����Ҫ�Ļ���ԭ�ϣ���;�dz��㷺��
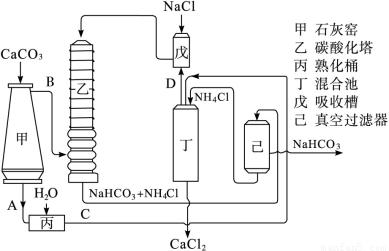
��1�����ð���õ���̼�����ƾ��������ɴ��������������ͼ��ʾ��
���ʾ��ͼ
ͼ�е��м����C��_________��D��________��д��ѧʽ����װ�����з�����Ӧ�Ļ�ѧ����ʽΪ_________________________________��
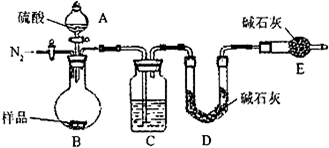
��2����ɽ�緢����������ǿ�����������Ҫ�Ļ���ԭ�����ᡣ����ҵ�ýӴ�������������õ���Ҫԭ������ǺͿ�����������������ͼ��ʾ��
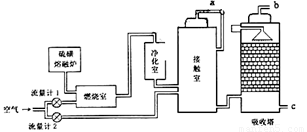
Ϊ�˳�����÷�Ӧ�ų����������Ӵ�����Ӧ��װ____________�����豸���ƣ������������������ɹܣ���������____________��Ϊʹ��dz��ȼ�գ���������1ͨ��ȼ���ҵ���������50����Ϊ���SO2��ת���ʣ���������2��������Ϊ�Ӵ�����SO2��ȫ����ʱ������������2.5��������������������������1��������2�Ŀ��������ӦΪ____________��
��8�֣�
(1)Ca(OH)2��1�֣���NH3��1�֣�;
NH3+CO2+H2O+NaCl= NaHCO3��+ NH4Cl��2�֣�
(2)�Ƚ�������1�֣�;����SO3��Ũ����ĽӴ������������SO3 �����գ�1�֣�;
6:5��2�֣�
��������
���������
(1)���������Ϣ���Եó�CΪʯ��Ҥ�IJ���CaO��H2O��������Ca(OH)2��DΪCa(OH)2��NH4Cl��Ӧ�IJ���NH3��װ�����з�����Ϊ�����Ƽ��Ҫ��Ӧ��ӦNH3+CO2+H2O+NaCl= NaHCO3��+ NH4Cl��
(2) Ϊ�˳�����÷�Ӧ�ų����������Ӵ�����Ӧ��װ�Ƚ��������������ɹܣ�������������SO3��Ũ����ĽӴ����������1molS��Ӧ�����ݷ���ʽS+O2=SO2����Ҫ1molO2������1molSO2,Ϊʹ��dz��ȼ�գ���������1ͨ��ȼ���ҵ���������50������Ҫ1.5molO2, 1molSO2�ڽӴ�����SO2��ȫ����ʱ����������Ϊ0.5mol����������2��������Ϊ�Ӵ�����SO2��ȫ����ʱ������������2.5����1.25mol����������������������1��������2�Ŀ��������ӦΪ1.5mol: 1.25mol=6:5
���㣺�����Ի�ѧ��������Ϊ������������Ԫ�ؼ����������ʡ�������ԭ��Ӧ���㣬���ͼ��Ļ�ѧ���㡣

 ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
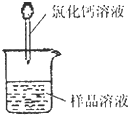
��У��ҵ��ϵ�д� ��2009?���Ŷ�ģ�������ǹ�ҵ�������ճ������е���Ҫ���ʣ�ij��ȤС��Ϊ�ⶨij��ҵ����������̼���������ʣ���̼���Ƶ������������������������ʵ�鷽������̽��������գ�
��2009?���Ŷ�ģ�������ǹ�ҵ�������ճ������е���Ҫ���ʣ�ij��ȤС��Ϊ�ⶨij��ҵ����������̼���������ʣ���̼���Ƶ������������������������ʵ�鷽������̽��������գ�