题目内容
将a g Mg、Al合金完全溶解在V1 L、c1 mol/L的盐酸溶液中,产生b g H2.再向反应后的溶液中加入V2 L,c2 mol/L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.则下列关系式错误的是( )
A、合金中的物质的量为
| ||
| B、d=a+17b | ||
C、c1=
| ||
| D、与金属反应后剩余盐酸的物质的量浓度为(c1V1-b)mol/L |
考点:有关混合物反应的计算
专题:计算题
分析:首先发生反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,加入NaOH溶液恰好使沉淀达到最大值,若盐酸剩余,首先发生反应HCl+NaOH═NaCl+H2O(盐酸不剩余,则不发生该反应),然后发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,MgCl2+2NaOH═MgAl(OH)2↓+2NaCl,
A.设合金中含有xmolMg,ymolAl,根据生成氢气的物质的量和金属的质量可列方程组计算合金中镁和铝的物质的量;
B.根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,根据电子转移计算金属提供的电子,沉淀质量=m(金属)+m(沉淀中氢氧根);
C.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH),据此计算;
D.总盐酸的物质的量减去生成氢气所用盐酸的物质的量即为剩余盐酸的物质的量,再根据c=
计算出剩余盐酸的浓度.
A.设合金中含有xmolMg,ymolAl,根据生成氢气的物质的量和金属的质量可列方程组计算合金中镁和铝的物质的量;
B.根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,根据电子转移计算金属提供的电子,沉淀质量=m(金属)+m(沉淀中氢氧根);
C.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH),据此计算;
D.总盐酸的物质的量减去生成氢气所用盐酸的物质的量即为剩余盐酸的物质的量,再根据c=
| n |
| V |
解答:
解:首先发生反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,加入NaOH溶液恰好使沉淀达到最大值,若盐酸剩余,首先发生反应HCl+NaOH═NaCl+H2O(盐酸不剩余,则不发生该反应),然后发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,MgCl2+2NaOH═MgAl(OH)2↓+2NaCl,
A.设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生bg H2,
,
解得
,则x+y=
mol,故A错误;
B.根据电子转移守恒可知,金属提供的电子物质的量为:
×2=bmol,根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,则d=a+b×17=a+17b,故B正确;
C.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH),则c1×V1=c2×V2,故c1=
,故C正确;
D、生成bgH2,其物质的量为0.5b mol,根据氢元素守恒,可知消耗盐酸bmol,则剩余HCl为(c1V1-b)mol,所以剩余盐酸的物质的量浓度为:
mol/L,故D错误;
故选AD.
A.设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生bg H2,
|
解得
|
| a-3b |
| 18 |
B.根据电子转移守恒可知,金属提供的电子物质的量为:
| bg |
| 2g/mol |
C.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH),则c1×V1=c2×V2,故c1=
| c2V2 |
| V1 |
D、生成bgH2,其物质的量为0.5b mol,根据氢元素守恒,可知消耗盐酸bmol,则剩余HCl为(c1V1-b)mol,所以剩余盐酸的物质的量浓度为:
| c1V1-b |
| V1 |
故选AD.
点评:本题考查混合物的计算,题目难度较大,理解反应过程、利用守恒的方法计算是关键,试题侧重对解题方法技巧越学生思维能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
“碧水千河扬长帆,蓝天白云飘纸鸢.草长莺飞千山绿,人与江山共画卷.”我们淮安市人民正在积极建设“碧水蓝天”的生态城市,下列措施中不合理的是( )
| A、限制化学工业发展,关停所有化工企业,消除污染源头 |
| B、积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 |
| C、加强城市生活污水脱氮除磷处理,遏制水体富营养化 |
| D、禁止农村燃烧秸杆,积极推广沼气、秸秆发电、秸秆制乙醇等实用技术的使用 |
下列有关实验原理、装置、操作或结论的描述中,正确的是( )
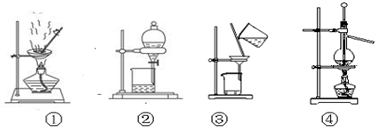

| A、用图①装置蒸发稀盐酸制浓盐酸 |
| B、用图②装置分液时,下层液体从分液漏斗下口放出,关闭活塞再将上层液体从上口倒出 |
| C、用图③洗涤沉淀时,漏斗中加入适量蒸馏水,搅拌并滤干 |
| D、用图④装置,分离四氯化碳与苯的混合溶液 |
取三份不同组成的镁铝混合物分别加入1mol/L的盐酸,待混合物完全溶解后,往溶液中加入1mol/L的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图.下列说法中错误的是( )


| A、图Ⅰ中a的取值范围为0≤a<50 | ||
B、图Ⅰ中
| ||
| C、图Ⅱ中a的取值范围为80<a<90 | ||
| D、图Ⅲ中a的取值范围为75<a<90 |
 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示.