题目内容
(Ⅰ)实验室制取氯气的装置如图: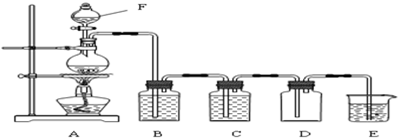
(1)仪器F的名称是
(2)装置B中盛放的试剂是
(3)写出E中发生反应的化学方程式:
(Ⅱ)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O
(1)该反应的氧化剂是
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)若用足量的浓盐酸与一定量的二氧化锰反应,产生的氯气在标准状况下的体积为11.2L,则反应中被氧化的HCl的质量为多少?(要求计算过程)
分析:(Ⅰ)(1)根据仪器的名称判断;实验室制氯气时,连接仪器后,要先检查装置的气密性;
(2)氯气中含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水、浓硫酸洗气瓶分别除去氯化氢和水蒸气,氯气有毒,用氢氧化钠吸收过量的氯气,防止空气污染;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(Ⅱ)(1)依据基本概念进行分析判断;化合价升高的元素具有还原性被氧化为氧化产物,化合价降低的元素具有氧化性被还原为还原产物;
(2)浓盐酸在反应中部分氯化氢中的氯元素化合价升高表现为还原性,和部分浓盐酸中氯化氢化合价不变表现为酸性;
(3)浓盐酸与二氧化锰反应方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,根据方程式计算.
(2)氯气中含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水、浓硫酸洗气瓶分别除去氯化氢和水蒸气,氯气有毒,用氢氧化钠吸收过量的氯气,防止空气污染;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(Ⅱ)(1)依据基本概念进行分析判断;化合价升高的元素具有还原性被氧化为氧化产物,化合价降低的元素具有氧化性被还原为还原产物;
(2)浓盐酸在反应中部分氯化氢中的氯元素化合价升高表现为还原性,和部分浓盐酸中氯化氢化合价不变表现为酸性;
(3)浓盐酸与二氧化锰反应方程式为MnO2+4HCl(浓)
| ||
解答:解:(Ⅰ)(1)装置图中F是分液漏斗用来盛放浓盐酸,实验室制氯气时,连接仪器后,要先检查装置的气密性,
故答案为:分液漏斗;检查装置的气密性;
(2)从A中制得的氯气含有氯化氢气体和水蒸气,气体通过饱和食盐水吸收氯化氢,通过浓硫酸吸收水蒸气得到干燥纯净的氯气,氯气有毒,用氢氧化钠吸收过量的氯气,防止空气污染,
故答案为:饱和食盐水;除氯化氢气体;氢氧化钠溶液;吸收过量的氯气;
(3)氯气和氢氧化钠反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(Ⅱ)(1)根据方程式可知锰元素由KMnO4中+7价降低到MnCl2中+2价,所以KMnO4在反应中做氧化剂被还原;氯元素由HCl中-1价升高到氯气中的0价,所以浓盐酸在反应中做还原剂,被氧化,对应氧化产物为氯气,
故答案为:KMnO4;Cl2;
(2)浓盐酸在反应中部分氯化氢中的氯元素化合价升高,表现为还原性,和部分浓盐酸中氯化氢化合价不变,表现为酸性,所以浓盐酸既表现酸性又表现出还原性,
故答案为:②;
(3)根据方程式可知参加反应的HCl中,做还原剂的HCl占反应消耗掉的HCl的一半则:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O 被氧化HCl的质量
22.4L 73g
11.2L m
解得:m=36.5g 所以反应中被氧化的HCl的质量为36.5g;
答:反应中被氧化的HCl的质量为36.5g.
故答案为:分液漏斗;检查装置的气密性;
(2)从A中制得的氯气含有氯化氢气体和水蒸气,气体通过饱和食盐水吸收氯化氢,通过浓硫酸吸收水蒸气得到干燥纯净的氯气,氯气有毒,用氢氧化钠吸收过量的氯气,防止空气污染,
故答案为:饱和食盐水;除氯化氢气体;氢氧化钠溶液;吸收过量的氯气;
(3)氯气和氢氧化钠反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(Ⅱ)(1)根据方程式可知锰元素由KMnO4中+7价降低到MnCl2中+2价,所以KMnO4在反应中做氧化剂被还原;氯元素由HCl中-1价升高到氯气中的0价,所以浓盐酸在反应中做还原剂,被氧化,对应氧化产物为氯气,
故答案为:KMnO4;Cl2;
(2)浓盐酸在反应中部分氯化氢中的氯元素化合价升高,表现为还原性,和部分浓盐酸中氯化氢化合价不变,表现为酸性,所以浓盐酸既表现酸性又表现出还原性,
故答案为:②;
(3)根据方程式可知参加反应的HCl中,做还原剂的HCl占反应消耗掉的HCl的一半则:
MnO2+4HCl(浓)
| ||
22.4L 73g
11.2L m
解得:m=36.5g 所以反应中被氧化的HCl的质量为36.5g;
答:反应中被氧化的HCl的质量为36.5g.
点评:本题考查了实验室制备氯气的装置分析和气体除杂方法,以及尾气的处理,氧化还原反应概念及计算,综合性强,题目难度中等.

练习册系列答案
相关题目
下列叙述中,正确的是( )
| A、次氯酸能杀死病菌,所以氯气可用于自来水的消毒 | B、实验室制取氯气时,常用水来吸收多余的氯气 | C、漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色 | D、氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
实验室制取氯气,常用排饱和食盐水的方法收集,原因是( )
| A、可产生更多的氯气 | B、只有饱和食盐水才能除去HCl杂质 | C、既能除去HCl,又能防止Cl2的溶解 | D、食盐水易得到 |