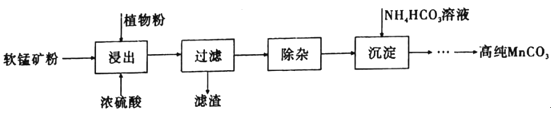
题目内容
【题目】比较下列四组△H(所有的△H均小于0)的大小,其中△H2<△H1的是( )
A.4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s) +3O2(g)=2Fe2O3(s) △H2
B.C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
C.S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
D.A(g) +B(g)=C(g) △H1 A(g)+B(g)=C(l) △H2
【答案】D
【解析】
A.①4Al(s)+3O2(g)=2Al2O3(s)△H1,②4Fe(s)+3O2(g)=2Fe2O3(s)△H2,由盖斯定律①-②:4Al(s)+2Fe2O3(s)=2Al2O3(s)+4Fe(s)△H1-△H2,铝热反应放热,所以△H1-△H2<0,即△H1<△H2,故A错误;
B.等量的C(s)燃烧生成CO2(g),即充分燃烧时放出的热量多,又燃烧为放热反应,△H<0,则△H1<△H2,故B错误;
C.固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H1<△H2,故C错误;
D.①A(g) +B(g)=C(g) △H1,②A(g)+B(g)=C(l) △H2,由盖斯定律①-②:C(l)=C(g) △H=△H1-△H2>0,因此△H1>△H2,故D正确;
故答案为D。

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
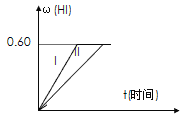
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
【题目】化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为___;
②下列能增大碳的转化率的措施是___;(填写相应字母)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
根据表中数据:
①计算反应CO2(g)+H2(g)![]() CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
CO(g)+H2O(g) 温度在973 K时的K=__;(结果保留小数点后2位)
②反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是___(填“吸热”或“放热”)反应。
③已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应__(填“已经”或“没有”)达到平衡,此时刻v正___v逆(填“>”、“<”或“=”)。