题目内容
(16分)氨气是一种重要的基础化工原料,用途广泛。
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2= +6H2O
工业中常用以下反应合成氨:N2+3H2 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,
C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,
C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
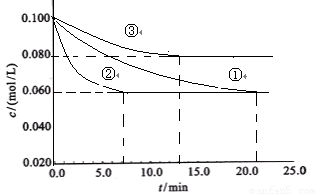
(1)该反应平衡常数的数学表达式 ;实验②平衡时H2的转化率为_______
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
【答案】
(16分)
N2(2分)
(1) (3分) 40%(3分)
(3分) 40%(3分)
(2)②加了催化剂;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同。(4分)
③温度高;该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①(4分)
【解析】

练习册系列答案
相关题目
 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)
= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)
= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。