��Ŀ����
����Ŀ������һ�ַdz����õĽ���Ԫ�أ��䵥�ʼ��������ڿ��С�������������Ҫ���ã�
��1�����ý����ƺ�CO2��Ӧ���Ʊ����ʯ������ط�Ӧ���Ȼ�ѧ����ʽ���£� 4Na��g��+3CO2��g���T2Na2CO3��l��+C��s�����ʯ����H=a kJmol��1
CO2��g��+4Na��g���T2Na2O��s��+C��s�����ʯ����H=b kJmol��1
��Ӧ6Na2O��s��+2C��s�����ʯ���T8Na��g��+2Na2CO3��l���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
��2��T��ʱ�����Ϊ2L�ĺ��������м���һ������Na2SO4������������������·�Ӧ�� Na2SO4��s��+4H2��g��Na2S��s��+4H2O��g����
���������¶ȣ�Kֵ��С����Ӧ�ġ�H0�������������
������˵��������� ��
A������Na2SO4��s�������ɼӿ췴Ӧ����
B�������������ܶ�һ��ʱ���÷�Ӧ�ﵽƽ��״̬
C�������¶Ȳ��䣬��ƽ����ϵ����ͨ��һ������H2 �� ��H����
D�������������䣬�����¶ȣ���v����������v���棩��С��ƽ������
����2min�ڷ�Ӧ�ﵽƽ�⣬��ʱ��������������8g������H2��ʾ�ķ�Ӧ����Ϊ����֪��Ӧ������H2�����������ʱ��Ĺ�ϵ����ͼ��ʾ����T���¸÷�Ӧ��ƽ�ⳣ��Ϊ ��
������Ӧ��ƽ�����һ������H2 �� �ٴ�ƽ���H2O������������������С�����䡱����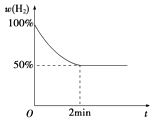
���𰸡�
��1����a��3b��
��2������ AD��0.125mol?L��1?min��1��1������
���������⣺��1����4Na��g��+3CO2��g���T2Na2CO3��l��+C��s�����ʯ����H=a kJmol��1
��CO2��g��+4Na��g���T2Na2O��s��+C��s�����ʯ����H=b kJmol��1
�ɸ�˹���ɿ�֪���٩��ڡ�3�õ���Ӧ6Na2O��s��+2C��s�����ʯ���T8Na��g��+2Na2CO3��l�������H=��a��3b��kJ/mol��
���Դ��ǣ���a��3b������2�����������¶ȣ�Kֵ��С����֪�����¶ȣ�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����Ӧ�ġ�H��0�����Դ��ǣ�����
��A������Na2SO4��s��������������Ӱ�죬��Ӧ���ʲ��䣬��A����
B����������������Ϊ���������ܶ�Ϊ����������������ܶ�һ��ʱ���÷�Ӧ�ﵽƽ��״̬����B��ȷ��
C�������¶Ȳ��䣬��ƽ����ϵ����ͨ��һ������H2����Ӧ��Ũ������H��Ũ���أ����H���䣬��C��ȷ��
D���÷�ӦΪ���ȷ�Ӧ�������������䣬�����¶ȣ���v��������v���棩��������ƽ�������ƶ�����D����
���Դ��ǣ�AD��
����2min�ڷ�Ӧ�ﵽƽ�⣬��ʱ��������������8g����
Na2SO4��s��+ | 4H2��g��Na2S��s��+4H2O��g�� | ��m |
4 | 64 | |
x | 8 |
��x= ![]() =0.5mol��
=0.5mol��
��H2��ʾ�ķ�Ӧ����Ϊv= ![]() =
= ![]() =0.125 molL��1min��1��
=0.125 molL��1min��1��
��ͼ��֪��������ת����Ϊ50%����ת��������Ϊ0.5mol��ƽ��ʱ����Ϊ0.5mol��ˮ����Ϊ0.5mol����K= ![]() =1��
=1��
���Դ��ǣ�0.125 molL��1min��1��1��
������Ӧ��ƽ�����һ������H2������¶Ȳ��䣬ѹǿ�����÷�ӦΪ�����������ķ�Ӧ��ƽ�ⲻ�ƶ������ٴ�ƽ���H2O������������䣬
���Դ��ǣ����䣮
�����㾫����ͨ��������÷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��ļ��㣬�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮

����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��

