题目内容
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程制得。
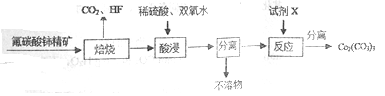
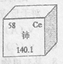
(1)如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图。则铈原子的质子数是______,氟碳酸铈的化学式为CeFCO3,该化合物中,Ce的化合价为_____________;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为______________;
(3)试剂X______________;
(4)已知298K时,Ksp[Ce(OH)4]=1×10-29,Ce(OH)4的溶度积表达式为Ksp=______________;为了使溶液中Ce4+沉淀完全,需调节pH为________以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL-1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积____________mL,若用硫酸酸化后改用0.1000molL-1
的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数__________(填“偏高”、“偏低”或“不变”)。
【答案】(1) 58 +3
(2)2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O
(3)Na2CO3
(4)c4(OH-)×c(Ce4+) 8
(5)46.6 偏低
【解析】
试题分析:(1)有信息示意图可知铈的核电荷数为58,即质子数为58;化合物中各元素化合价之和为0,CeFCO3中Ce的化合价为x,则x+(-1)+(+4)+(-2)×3=0,x=+3;
(2)二氧化铈的Ce为+4价,在酸浸时,固体CeO2 被溶解,且被还原为了+3价的Ce3+,在酸性条件下发生氧化还原反应,方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)在酸浸后,经过分离不溶物,得到含有Ce3+的溶液,加入Na2CO3溶液,中和(2)中酸液,使Ce3+转化为Ce2(CO3)3沉淀;
(4)已知Ce(OH)4 (aq)![]() Ce4+(aq)+4OH-(aq),此反应的Ksp=c4(OH-)×c(Ce4+);当溶液中c(Ce4+)小于10-5mol/L时,沉淀完全,此时c4(OH-)=
Ce4+(aq)+4OH-(aq),此反应的Ksp=c4(OH-)×c(Ce4+);当溶液中c(Ce4+)小于10-5mol/L时,沉淀完全,此时c4(OH-)=![]() =1×10-24,则c(OH-)=1×10-6mol/L,此时溶液的pH=8;
=1×10-24,则c(OH-)=1×10-6mol/L,此时溶液的pH=8;
(5)Ce(OH)4产品在用硫酸溶解后生成了Ce4+,所以用还原剂滴定该溶液,Ce4+变成了Ce3+,而Fe2+被氧化成了Fe3+,所以根据电子的是守恒计算,n[Ce(OH)4]=n(FeSO4)=cV=0.1000 molL-1×V×10-3L=![]() mol,V=46.6;如果改用FeCl2溶液滴定,则Cl-也能被Ce4+氧化,实际消耗的标准液偏少,测定结果偏低。
mol,V=46.6;如果改用FeCl2溶液滴定,则Cl-也能被Ce4+氧化,实际消耗的标准液偏少,测定结果偏低。

 阅读快车系列答案
阅读快车系列答案【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________________。
(2)装置乙,若电路中转移6.02×1022个e﹣,则C上增加的质量为 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________________。