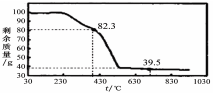
题目内容
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
| 编号 | V (Na2CO3)/mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是 。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
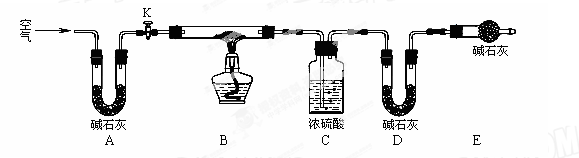
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
(1) ①n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1 75℃ ②有少量孔雀石受热分解为CuO
(2)打开活塞K,继续通一段时间空气 ①除去空气中的CO2和H2O 偏小
②BC、BD、CD(3分) 5Cu(OH)2·2CuCO3
(除倒数第二空3分外,其余每空2分,最佳条件缺一扣1分,答错不给分。共15分)
解析试题分析:(1) ①由表中数据,0.25mol·L–1的Na2CO3溶液2mL时生成的碱式碳酸铜最多,此时n[Cu(NO3)2]:n(Na2CO3)=2:1;当温度在75℃,生成的碱式碳酸铜最佳。②温度较高,少量孔雀石受热分解生成CuO,孔雀石中含有的少量褐色物质是氧化铜。
(2)反应完毕后,需要继续通空气,让装置冷却。①装置A碱石灰是干燥剂,可吸收空气中的水蒸气和二氧化碳,防止对装置CD增重的数据造成影响,装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置,D装置是吸收生成的二氧化碳的,C装置是吸收生成的水的,如果没有装置E,会使D装置质量增重偏大,即生成的二氧化碳质量偏大,则x/y的值会偏小。
②碱式碳酸铜分解的化学方程xCu(OH)2·yCuCO3 (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑
要测定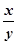 的值,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量;故可选CD。
的值,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量;故可选CD。
xCu(OH)2·yCuCO3  (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑
18x 44y
9g 8.8g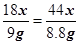
∴ 
若测出反应后玻璃管中样品的质量以及装置C增重的质量,即已知生成的氧化铜和水的质量,可求出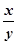 的值;故可选BC。
的值;故可选BC。
xCu(OH)2·yCuCO3 (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑
(x+y)×80 18x
56g 9g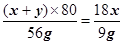
∴ 
同样若已知反应后玻璃管中样品的质量以及装置D增重的质量,即已知生成的氧化铜和二氧化碳的质量,可求出出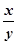 的值;故可选BD。
的值;故可选BD。
xCu(OH)2·yCuCO3  (x+y)CuO + xH2O + yCO2↑
(x+y)CuO + xH2O + yCO2↑
(x+y)×80 44y
56g 8.8g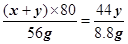
∴
考点:化学实验综合考查,包括实验原理、实验装置、误差分析、数据处理及根据化学方程式的计算。

 名校课堂系列答案
名校课堂系列答案实验室制备苯乙酮的化学方程式为:
制备过程中还有CH3COOH+AlCl3―→CH3COOAlCl2+HCl↑等副反应。
主要实验装置和步骤如下:
(Ⅰ)合成:在三颈瓶中加入20g无水三氯化铝和30mL
无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6mL
乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液
缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层②水层用苯萃取,分液③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品④蒸馏粗产品得到苯乙酮
回答下列问题:(1)仪器a的名称:________;装置b的作用:________。
(2)合成过程中要求无水操作,理由是_______________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |
(5)分液漏斗使用前须________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先________,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)粗产品蒸馏提纯时,下列装置中温度计位置正确的是________,可能会导致收集到的产品中混有低沸点杂质的装置是________。

掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。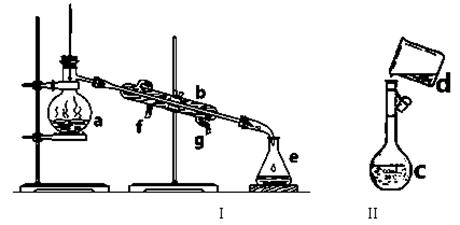
⑴写出下列仪器的名称:a. b. c.
⑵仪器a~c中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,
将仪器补充完后进行实验,温度计水银球的位置在 处。
冷凝水由 (填f或g)口通入。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有: 。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
下列实验操作与预期实验目的或结论均正确的是( )
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较Si和C的电负性 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。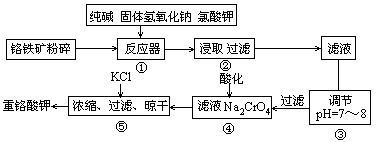



 Mg(OH)2
Mg(OH)2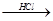 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg