题目内容
【题目】现代人追求“低碳生活” ,二氧化碳的回收并利用是环保领域研究的热点和重点。试分析并回答:
(1)有一最新美国科学家的研究成果,利用金属钛和某些装置等,模仿太阳的蓝色波长,使CO2慢慢发生人工“光合作用” 后,被还原成太阳能燃料——甲酸等,该化学方程式是_____________________________;
(2)另有一种用CO2生产甲醇燃料的方法:
CO2+3H2=CH3OH+H2O。已知298 K和101 kPa条件下:
CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热ΔH=________。
(3)工业上合成尿素的反应如下:
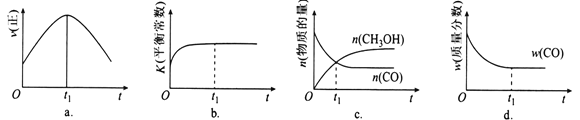
2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(l) ΔH<0,某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质浓度的变化曲线如图所示。
①为提高尿素的产率,下列可以采取的措施有________;
A.缩小反应容器的容积
B.升高温度
C.平衡体系中分离出部分CO(NH2)2
D.使用合适的催化剂
②若保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,则此时v正________v逆(填“>”“=”或“<”),判断理由_____________________________;
③若保持平衡的温度和体积不变,25 min时再向容器中充入2 mol氨气和1 mol二氧化碳,在40 min时重新达到平衡,请在上图中画出25~50 min内氨气的浓度变化曲线________________。
(4)多孔Al2O3薄膜可作为催化剂载体、模板合成纳米材料等用途。现以高纯铝片作为阳极,不锈钢作为阴极,一定溶度的磷酸溶液作为电解质进行电解,即可初步制取多孔Al2O3膜。请写出该制取过程的阳极电极反应:__________________________________________。
(5)要实现CO2直接加H2合成汽油,关键是_____________________________。
【答案】2CO2+2 H2O=2HCOOH+O2 (a+c-1.5b) kJ·mol-1 A < 保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,体系的体积变大,氨气和二氧化碳的浓度会改变,分别为0.25 mol/L和0.05 mol/L,平衡会向逆反应方向移动,所以逆反应速率大  2Al+3H2O-6e-=Al2O3+6H+ 选择合适的催化剂
2Al+3H2O-6e-=Al2O3+6H+ 选择合适的催化剂
【解析】
(1)CO2发生人工“光合作用” ,是CO2与水作用生成甲酸的同时,必有O2生成;
(2)根据盖斯定律进行计算;
(3)①为提高尿素的产率,可以使化学平衡向着正反应方向进行;
②若保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,体系的体积变大,氨气和二氧化碳的浓度会改变,分别为0.25 mol/L和0.05 mol/L,平衡会向逆反应方向移动,所以逆反应速率大;
③25 min时再向容器中充入2 mol氨气和1 mol二氧化碳,在40 min时重新达到平衡,则建立的是等效平衡,氨气的平衡浓度保持不变;
(4)根据题意,以高纯铝片作为阳极制备多孔Al2O3薄膜,以一定溶度的磷酸溶液作为电解质进行电解,即由Al转化为Al2O3;
(5)要实现CO2直接加H2合成汽油,关键是寻找合适的催化剂。
(1)CO2发生人工“光合作用” ,是CO2与水作用生成甲酸的同时,必有O2生成,配平即可,化学方程式是2CO2+2 H2O=2HCOOH+O2;
(2)甲醇燃烧热的方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l), 结合题目所给信息,CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1 ②
CH3OH(g)=CH3OH(l) ΔH=-c kJ·mol-1 ③
燃烧热的方程式可以由上面三个方程:②×1.5-①-③得到,所以答案为:(a+c-1.5b) kJ·mol-1;
(3)①为提高尿素的产率,可以使化学平衡向着正反应方向进行,
A.缩小反应容器的容积,即增大压强,化学平衡正向移动,选项A正确;
B.升高温度,化学平衡2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH1<0逆向移动,选项B错误;
NH2COONH4(s) ΔH1<0逆向移动,选项B错误;
C.平衡体系中分离出部分CO(NH2)2,由于CO(NH2)2是液态,所以没有影响,选项C错误;
D.使用合适的催化剂,不会引起平衡的移动,选项D错误。
答案选A;
②若保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,体系的体积变大,氨气和二氧化碳的浓度会改变,分别为0.25 mol/L和0.05 mol/L,平衡会向逆反应方向移动,所以逆反应速率大,答案为<;
③25 min时再向容器中充入2 mol氨气和1 mol二氧化碳,在40 min时重新达到平衡,则建立的是等效平衡,氨气的平衡浓度保持不变,曲线如下:

(4)根据题意,以高纯铝片作为阳极制备多孔Al2O3薄膜,以一定溶度的磷酸溶液作为电解质进行电解,即由Al转化为Al2O3,缺氧元素,可以从水中获得氧元素,而氢则以离子形式存在;该制取过程的阳极电极反应为:2Al+3H2O-6e-=Al2O3+6H+;
(5)要实现CO2直接加H2合成汽油,关键是寻找合适的催化剂,如中科院大连所专家已于最近成功实现了CO2直接加氢制取高辛烷值汽油,采用的是新型复合催化剂含Fe3O4等,方程式为:8CO2+25H2![]() C8H18+16H2O。
C8H18+16H2O。

【题目】![]() 时.体积均为
时.体积均为![]() 的两个恒容密闭容器中发生可逆反应:
的两个恒容密闭容器中发生可逆反应:![]()
![]() 实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是
实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是![]()
容器编号 | 起始时各物质物质的量 | 达到平衡时体系能量的变化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常数均为36
中的平衡常数均为36
B.向容器![]() 中通入氦气,平衡时A的转化率不变
中通入氦气,平衡时A的转化率不变
C.容器![]() 中达到平衡时放出的热量为/span>
中达到平衡时放出的热量为/span>![]() QkJ,达到平衡时,两个容器中C的物质的量浓度均为
QkJ,达到平衡时,两个容器中C的物质的量浓度均为![]()
![]()
D.其他条件不变,若容器![]() 保持恒容绝热,则达到平衡时C的体积分数小于
保持恒容绝热,则达到平衡时C的体积分数小于![]()
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:![]() 三氯化氮
三氯化氮![]() 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量![]() ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。![]() 一定条件下,不同物质的量的
一定条件下,不同物质的量的![]() 与不同体积的
与不同体积的![]() 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
反应序号 | n | V | 放出的热量 |
1 |
|
| A |
2 |
|
| b |
该条件![]() 与NaOH 溶液反应生成
与NaOH 溶液反应生成![]() 的热化学反应方程式为______。
的热化学反应方程式为______。![]() 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的 ,其反应为:
,其反应为:![]() ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温![]() 温度分别为
温度分别为![]() 、
、![]() 容器中分别加入
容器中分别加入![]() 和
和![]() ,测得各容器中
,测得各容器中![]() 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率![]() ______。
______。![]() 该反应的
该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。![]() 常温下,在
常温下,在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() ______。
______。![]() 已知常温下,
已知常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]()
![]() 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将![]() 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示
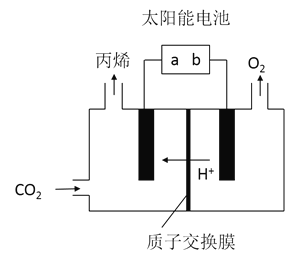
![]() 太阳能电池的负极是______
太阳能电池的负极是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。