题目内容
【题目】海水是巨大的资源宝库,人类可以从海水中提取各种化工产品。下图是某工厂对海水综合利用的示意图:
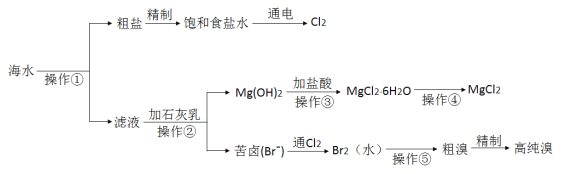
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________,检验氯气生成的方法是_________。
(2)液氯储存在钢瓶中,钢瓶上应贴的标签为_________________(选填编号)。
a.自燃品 b.爆炸品 c.有毒品 d.易燃品
(3)Mg(OH)2加入盐酸充分反应后,操作③ 是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为____________________________。
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因________________。
(5)操作⑤是向溶液中鼓入__________,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有____________性。
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br,再通Cl2,最后蒸馏得到高纯溴。用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为_________。由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________。
【答案】![]() 用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成 C 加热浓缩、冷却结晶、过滤、洗涤、干燥 边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气 热空气或水蒸气 挥发性 SO2+Br2+2H2O=4H++2Br-+SO42- 强酸对设备的严重腐蚀问题
用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成 C 加热浓缩、冷却结晶、过滤、洗涤、干燥 边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气 热空气或水蒸气 挥发性 SO2+Br2+2H2O=4H++2Br-+SO42- 强酸对设备的严重腐蚀问题
【解析】
海水晒盐后过滤分离出滤液和粗盐,①为过滤,粗盐经精制得到较为纯净的氯化钠,电解饱和食盐水可用于制备氢氧化钠、氯气和氢气,滤液加入石灰乳沉淀镁离子后操作②为过滤,在滤液中通入Cl2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,操作⑤中利用SO2吸收发生SO2+Br2+2H2O=4H++2Br-+SO42-;再通入Cl2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集;氢氧化镁加入盐酸溶解得到氯化镁溶液,氯化镁溶液中得到氯化镁晶体,操作③是加热蒸发、冷却结晶得到无水氯化镁,操作④为电解熔融氯化镁得到金属镁,以此解答该题。
:(1)电解饱和食盐水的化学方程式为![]() ,检验氯气生成的方法是用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成,
,检验氯气生成的方法是用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成,
故答案为:![]() ;用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成;
;用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成;
(2)液氯有毒,储存在钢瓶中,钢瓶上应贴的标签为c,
故答案为:c;
(3)Mg(OH)2加入盐酸充分反应后,操作③是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为加热浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:加热浓缩、冷却结晶、过滤、洗涤、干燥;
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因为边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气,
故答案为:边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气;
(5)操作⑤是向溶液中鼓入热空气或水蒸气,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有挥发性,
故答案为:热空气或水蒸气;挥发;
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br-,再通Cl2,最后蒸馏得到高纯溴,用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀问题,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;强酸对设备的严重腐蚀问题。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案