题目内容
V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol?L-1,SO2-4的物质的量浓度为________ mol?L-1,溶夜的物质的量浓度为________ mol?L-1.



分析:根据n=
 计算m gFe3+的物质的量,再根据c=
计算m gFe3+的物质的量,再根据c= 计算该溶液中Fe3+的物质的量浓度;
计算该溶液中Fe3+的物质的量浓度;根据电荷守恒可知3c(Fe3+)=2c(SO2-4),据此计算SO2-4的物质的量浓度;
由Fe3+守恒可知,c[Fe2(SO4)3]=
 c(Fe3+).
c(Fe3+).解答:m gFe3+的物质的量为
 =
= mol,则该溶液中Fe3+的物质的量浓度为
mol,则该溶液中Fe3+的物质的量浓度为 =
= mol/L;
mol/L;根据电荷守恒可知3c(Fe3+)=2c(SO2-4),故c(SO2-4)=
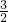 c(Fe3+)=
c(Fe3+)=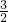 ×=
×= mol/L=
mol/L= mol/L;
mol/L;由Fe3+守恒可知,c[Fe2(SO4)3]=
 c(Fe3+)=
c(Fe3+)= ×
× mol/L=
mol/L= mol/L;
mol/L;故答案为:
 ;
; ;
; .
.点评:本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解灵活运用,注意电解质浓度与相应离子浓度的关系.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
 的物质的量浓度是
的物质的量浓度是



 的物质的量浓度是( )
的物质的量浓度是( )


