题目内容
7.将2.7g铝溶解于100mL3mol/LNaOH溶液中,然后向所得溶液中加入400mL,1mol/L的盐酸,最后可得沉淀的质量是( )| A. | 2.7g | B. | 5.2g | C. | 7.8g | D. | 10g |
分析 金属铝溶于氢氧化钠发生反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,加入盐酸,先是会和剩余的NaOH反应:NaOH+HCl=NaCl+H2O,然后发生反应:H2O+NaAlO2+HCl=NaCl+Al(OH)3↓,若盐酸再剩余,则盐酸会将沉淀溶解,即发生反应:3HCl+Al(OH)3=AlCl3+3H2O,据此进行计算即可.
解答 解:2.7铝的物质的量=$\frac{2.7g}{27g/mol}$=0.1mol,NaOH的物质的量=0.1L×3mol/L=0.3mol,
2 Al+2 NaOH+2H2O=2NaAlO2+3H2↑,
2 2 2
0.1mol 0.1mol 0.1mol
生成NaAlO2为0.2mol,溶解金属铝后剩余的氢氧化钠是:0.3mol-0.1mol=0.2mol,
再加入盐酸,先是和氢氧化钠反应,则:
NaOH+HCl=NaCl+H2O
0.2mol 0.2mol
中和NaOH后剩余HCl为0.4L×1mol/L-0.2mol=0.2mol,
然后剩余的盐酸发生反应:H2O+NaAlO2+HCl=NaCl+Al(OH)3↓
0.1mol 0.1mol 0.1mol
还会剩余HCl为0.2mol-0.1mol=0.1mol,最后的反应是:
3HCl+Al(OH)3=AlCl3+3H2O
3 1
0.1 $\frac{0.1mol}{3}$
最后可得沉淀氢氧化铝的质量是(0.1mol-$\frac{0.1mol}{3}$)×78g/mol=5.2g.
故选:B.
点评 本题考查利用化学反应方程式的计算,题目涉及过量计算,明确发生的反应即可解答,难度不大.


某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣B的主要成分有Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(2)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂,高铁酸钾溶液长时间放置不稳定,会产生红褐色絮状物质及一种助燃性的气体,则该过程的离子方程式为4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)为测定三草酸合铁酸钾晶体中草酸根的含量,通常将其配成溶液再用H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4-同时被还原为Mn2+此反应不要(要/不要)外加指示剂,达到滴定终点的现象为当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点.
| A. | σ键是原子轨道以“头碰头”的方式相互重叠 | |
| B. | 共价化合物分子的键能越大,键长越长,则分子越稳定 | |
| C. | 2个原子形成多个共价键中,只有一个σ键,而π键可以是一个或多个 | |
| D. | 形成共价键时键与键重叠程度越大,体系能量越底,键越稳定 |





 短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
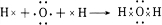 ,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
 根据如图回答问题.
根据如图回答问题.