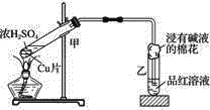
题目内容
【题目】室温下,向10mL 0.1mol/LHX溶液中逐滴加入0.2molL1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论正确的是( )
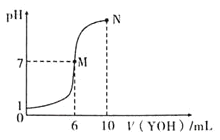
A.M点不存在:c(Y+)=c(X-)
B.N点水的电离程度大于M点水的电离程度
C.25℃时pH=4的YX溶液中电离出的c(H+)=1.0×![]()
D.N点对应溶液中粒子浓度关系存在:![]()
【答案】D
【解析】
开始时,0.1mol/LHX溶液的pH=1是强酸,![]() 与YOH恰好完全中和生成盐,需要YOH溶液5mL,如果YOH为强碱,则在横坐标为5mL时,pH=7,但是图象显示横坐标为6 mL时,pH=7,由此确定YOH为弱碱,据此分析。
与YOH恰好完全中和生成盐,需要YOH溶液5mL,如果YOH为强碱,则在横坐标为5mL时,pH=7,但是图象显示横坐标为6 mL时,pH=7,由此确定YOH为弱碱,据此分析。
A.由电荷守恒可知,c(Y+)+ c(H+)=c(X-)+c(OH-),M点溶液呈中性,c(H+)= c(OH-),M点存在:c(Y+)=c(X-),故A错误;
B.M点,水电离的H+浓度为![]() ,N点溶液呈碱性,YOH电离的OH-抑制了水电离,水电离的H+浓度小于
,N点溶液呈碱性,YOH电离的OH-抑制了水电离,水电离的H+浓度小于![]() ,所以M点水的电离程度大于N点水的电离程度,故B错误;
,所以M点水的电离程度大于N点水的电离程度,故B错误;
C.YX溶液中存在![]() ,促进水的电离,所以pH=4的YX溶液中水电离出的
,促进水的电离,所以pH=4的YX溶液中水电离出的![]() ,故C错误;
,故C错误;
D.N点为YOH与YX物质的量之比为1:1(YOH与YX等量混合),由物料守恒可以得:![]() ,由电荷守恒可得
,由电荷守恒可得![]() ,消去
,消去![]() 可得,
可得,![]() ,或者根据质子守恒也可以得到
,或者根据质子守恒也可以得到![]() ,故D正确;
,故D正确;
答案选D。

【题目】![]() 和
和![]() 既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(
既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(![]() )的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
)的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
(1)已知在![]() 、298K条件下,各物质燃烧热数据如下表:
、298K条件下,各物质燃烧热数据如下表:
物质(g) |
|
|
|
|
燃烧热( | -890.0 | -283.0 | -285.0 | 0 |
则甲烷与二氧化碳重整反应制合成气的热化学方程式为:________________;
(2)在T℃时,向容积为2L的刚性容器中充入![]()
![]() 和
和![]()
![]() 。反应体系中
。反应体系中![]() 的物质的量随时间变化关系如下表:
的物质的量随时间变化关系如下表:
时间/min | 0 | 20 | 50 | 100 | |
| 0.5 | 0.48 | 0.25 | 0.25 | 0.25 |
①20min时,![]() ________
________![]() ;当反应进行到60min时,
;当反应进行到60min时,![]() ________20min时
________20min时![]() 的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________。
的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________。
A.将反应时间延长至150min B.移除一部分合成气
C.适当提高反应升高温度 D.改用高效催化剂
②反应进行到下列各图的p点时,能够说明该反应达到平衡状态的是:___________。
A. B.
B. C.
C.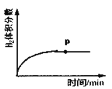 D.
D.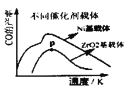
③已知:p(H2)、p(CO)、p(CH4)和p(CO2)为各组分的平衡分压(气体分压p=气体总压p总×体积分数),p总为平衡总压。若开始测得反应体系的压强为3.0Mpa,则合成气反应达到平衡状态时Kp=________。(结果保留一位小数)
(3)由于原料气的![]() 比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%
比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%![]() 催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________(横坐标表示Sr助剂的质量含量),判断的理由是________________(写出两点)
催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________(横坐标表示Sr助剂的质量含量),判断的理由是________________(写出两点)

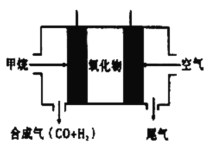
(4)如图所示,以![]() 为燃料气,高温电化学法制备合成气的发电系统中,
为燃料气,高温电化学法制备合成气的发电系统中,![]() 在电场作用下,通过氧化物电解质中氧空位迁移到负极,与
在电场作用下,通过氧化物电解质中氧空位迁移到负极,与![]() 发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________。
发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________。