题目内容
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
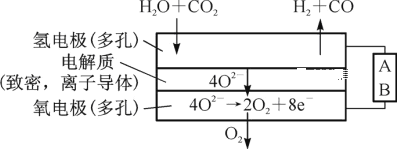
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:________。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O3.2g负极H2O+2e-=H2↑+O2-
【解析】
(1)①原电池中负极发生失去电子的氧化反应,则甲醇在负极通入,由于电解质溶液显碱性,则该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。
②石墨做电极,阳极首先是氯离子放电,然后是氢氧根离子放电,阴极首先是铜离子放电,然后是氢离子放电。溶液中铜离子、氢离子和氯离子的物质的量分别是0.1mol、0.4mol、0.4mol,由于两极收集到相同体积,这说明氢离子放电后继续电解水。设生成氧气的物质的量是x mol,则根据电子得失守恒可知0.1mol×2+(0.2+x)mol×2=0.4mol×1+x mol×4,解得x=0.1,所以阳极上收集到氧气的质量为0.1mol×32g/mol=3.2g。
(2)氧离子在阳极发生失去电子的氧化反应,阳极与电源的正极相连,则由图可知B是正极,因此A是负极。氢气在阴极生成同时产生氧离子,则以H2O为原料生成H2的电极反应式为H2O+2e-=H2↑+O2-。

 阅读快车系列答案
阅读快车系列答案【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是HCOOH>HCN> H2CO3
B. HCOOH的电离平衡常数表达式为
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN
【题目】用如图所示装置和相应试剂能达到实验目的的是( )
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的NO | 浓硝酸 | Cu | 水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D