题目内容
T1℃时,向一体积不变的密闭容器中加入1mol A、2mol B和0.5mol C三种气体发生反应,各物质浓度随时间变化如图一所示,其中c(C)的变化未画出来,但t1时刻c(C)=c(D);图二为t2时刻后改变反应条件,A的转化率与温度、压强的关系
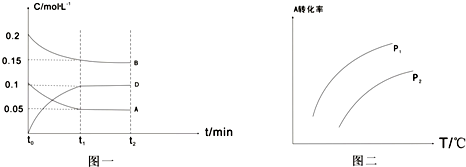
(1)t1=5min,则t0~t1阶段以C的浓度变化表示反应速率为v(C)=
(2)根据图二分析,温度升高,该反应的平衡常数将
(3)若上述反应在T1℃、恒压下进行,A的转化率会
(4)在相同条件下(T1℃时,体积不变的密闭容器中),若起始时容器中加入2molD、

(1)t1=5min,则t0~t1阶段以C的浓度变化表示反应速率为v(C)=
0.01mol?L-1?min-1
0.01mol?L-1?min-1
,该反应的化学方程式为A(g)+B(g)?C(g)+2D(g)
A(g)+B(g)?C(g)+2D(g)
(2)根据图二分析,温度升高,该反应的平衡常数将
增大
增大
(填“增大”“减小”或“不变”),压强P1<
<
P2 (填“>”“<”或“=”)(3)若上述反应在T1℃、恒压下进行,A的转化率会
减小
减小
(填“增大”“减小”或“不变”)(4)在相同条件下(T1℃时,体积不变的密闭容器中),若起始时容器中加入2molD、
1
1
molB和1.5
1.5
molC,才能达到t1时刻同样的平衡.分析:(1)根据图一中t0时A的浓度为0.1mol/L可知容器的容积为10L,根据c=
计算出反应开始前C的浓度,再计算出t0~t1阶段以C的浓度变化表示反应速率为v(C);再根据达到平衡时A、B、C、D的浓度变化计算出各物质的化学计量数,并写出反应的方程式;
(2)根据温度升高A的转化率增大,反应物浓度减小,生成物浓度增大判断平衡常数变化;根据在相同温度下压强对A的转化率的影响及反应方程式判断压强大小;
(3)根据反应A(g)+B(g)?C(g)+2D(g)为体积减小的反应,达到平衡时物质的量减小,压强减小,恒压下相当于增大了压强,平衡向着逆向移动;
(4)根据等效平衡进行分析起始时容器中加入2molD需要其它各组分的浓度.
| n |
| V |
(2)根据温度升高A的转化率增大,反应物浓度减小,生成物浓度增大判断平衡常数变化;根据在相同温度下压强对A的转化率的影响及反应方程式判断压强大小;
(3)根据反应A(g)+B(g)?C(g)+2D(g)为体积减小的反应,达到平衡时物质的量减小,压强减小,恒压下相当于增大了压强,平衡向着逆向移动;
(4)根据等效平衡进行分析起始时容器中加入2molD需要其它各组分的浓度.
解答:解:(1)图一中t0时A的浓度为0.1mol/L,则容器的容积为:V=
=
=10L,反应开始前C的浓度为:c(C)=
=0.05mol/L,t1=5min,则t0~t1阶段以C的浓度变化表示反应速率为v(C)=
=
=0.01mol?L-1?min-1;
各物质的浓度之比等于反应中的化学计量数之比,△c(A):△c(B):△c(C):△c(D)=(0.1-0.05)mol.L-1:(0.2-0.15)mol.L-1:(0.1-0.05)mol.L-1:(0.1)mol.L-1=1:1:1:2,该反应的化学方程式为:A(g)+B(g)?C(g)+2D(g),
故答案为:0.01mol?L-1?min-1;A(g)+B(g)?C(g)+2D(g);
(2)温度升高,A的转化率增大,反应物浓度减小,生成物的浓度增大,所以平衡常数增大;在相同的温度下,A的转化率P1>P2,反应A(g)+B(g)?C(g)+2D(g)中,压强增大,平衡向着逆向移动,即压强越大,A的转化率越低,所以P1<P2,
故答案为:增大;<;
(3)原先的反应中,反应体系的总物质的量减小,压强会减小;该反应的正反应为体积增大的反应,若是恒压下反应,平衡向着逆向移动,A的转化率会减小,
故答案为:减小;
(4)根据等效平衡,将各组分的量按照化学计量数转化成原先的各组分的物质的量,只要物质的量相等,就是等效平衡;原先D的物质的量为0,所以将D按照计算量完全转化成反应物,会生成1molA、1molB,同时消耗1molC,原反应中有1molA、2molB和0.5molC,所以此时还需要加入(1-1)mol=0molA、(2-1)mol=1molB和(0.5+1)mol=1.5molC,
故答案为:1;1.5.
| n |
| c(A) |
| 1mol |
| 0.1mol/L |
| 0.5mol |
| 10L |
| △c |
| △t |
| 0.1nol/L-0.05mol/L |
| 5min |
各物质的浓度之比等于反应中的化学计量数之比,△c(A):△c(B):△c(C):△c(D)=(0.1-0.05)mol.L-1:(0.2-0.15)mol.L-1:(0.1-0.05)mol.L-1:(0.1)mol.L-1=1:1:1:2,该反应的化学方程式为:A(g)+B(g)?C(g)+2D(g),
故答案为:0.01mol?L-1?min-1;A(g)+B(g)?C(g)+2D(g);
(2)温度升高,A的转化率增大,反应物浓度减小,生成物的浓度增大,所以平衡常数增大;在相同的温度下,A的转化率P1>P2,反应A(g)+B(g)?C(g)+2D(g)中,压强增大,平衡向着逆向移动,即压强越大,A的转化率越低,所以P1<P2,
故答案为:增大;<;
(3)原先的反应中,反应体系的总物质的量减小,压强会减小;该反应的正反应为体积增大的反应,若是恒压下反应,平衡向着逆向移动,A的转化率会减小,
故答案为:减小;
(4)根据等效平衡,将各组分的量按照化学计量数转化成原先的各组分的物质的量,只要物质的量相等,就是等效平衡;原先D的物质的量为0,所以将D按照计算量完全转化成反应物,会生成1molA、1molB,同时消耗1molC,原反应中有1molA、2molB和0.5molC,所以此时还需要加入(1-1)mol=0molA、(2-1)mol=1molB和(0.5+1)mol=1.5molC,
故答案为:1;1.5.
点评:本题考查了转化率随温度、压强的变化曲线,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力及灵活应用所学知识的能力,能够提高学生的应试能力和学习效率.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
向一体积不变的密闭容器中加入2mol X、0.6mol Z和一定量的Y三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示,其中t0-t1阶段C(Y)未画出.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段各改变一种不同的条件(浓度、温度、压强、催化剂),其中t3-t4阶段为使用催化剂.则下列说法不正确的是( )
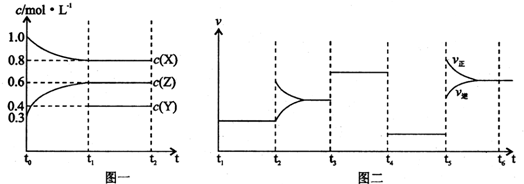

| A、Y的起始物质的量为1.0 mol | ||||
| B、t4-t5阶段改变的条件为减小压强;t5-t6是升高温度 | ||||
| C、此温度下该反应的化学方程式为2X(g)+Y(g)?2Z(g) | ||||
D、在相同条件下,若起始时容器中加入a mol X b mol Y和c mol Z,要达到t1时刻同样的平衡,a,b,c要满足的条件为a+
|
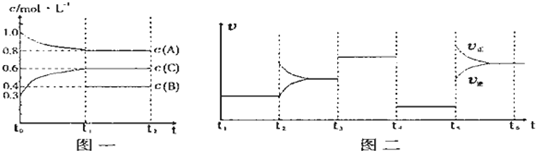
 3C(g)
3C(g)
