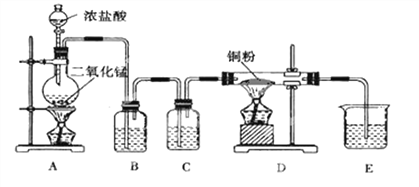
题目内容
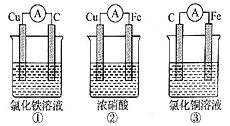
【题目】(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______,写出正极的电极反应_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
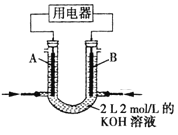
①实验测得OH-定问移向B电极,则_____处电极入口通甲烷(填A或B),其电极反应式为___________。
②当消耗甲院的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。
【答案】 ③ Cu2++2e-=Cu 3g B CH4-8e-+10OH-=CO32-+7H2O 9.6mol Zn-2e-+2OH-=Zn(OH)2 1 增强
【解析】(1)①中铜是负极,碳是正极,铁离子在正极放电生成亚铁离子,不能比较Fe2+与Cu2+氧化性强弱;②中在常温下铁遇浓硝酸发生钝化,铁是正极,铜是负极,不能比较Fe2+与Cu2+氧化性强弱;③中铁是负极,碳是正极,铜离子在正极得到电子生成铜,能比较Fe2+与Cu2+氧化性强弱,正极的电极反应为Cu2++2e-=Cu。当导线中通过0.05mol电子时,消耗铁0.025mol×56=1.4g,析出铜是0.025mol×64g/mol=1.6g,则两个电极的质量差为1.4g+1.6g=3.0g;(2)①实验测得OH-定问移向B电极,则B电极是负极,因此B处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-=CO32-+7H2O。②甲院的体积为33.6L(标准状况下),物质的量是1.5mol,假设电池的能量转化率为80%,则导线中转移电子的物质的量为1.5mol×80%×8=9.6mol。(3)反应中锌失去电子,则原电池负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2;铁元素化合价从+6价降低到+3价,放电时每转移3mol电子,有1molK2FeO4被还原。正极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,因此正极附近溶液的碱增强。

【题目】研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答: 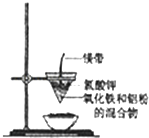
(1)氧化铁与铝反应的化学方程式是 ,
(2)镁带的作用是;氯酸钾的作用是 .
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣ |
同学们分析数据后推测该熔融物是一种合金,其中的金属是 , 溶解该合金可选用下列试剂中的(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.