题目内容
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| B. | 标准状况下,11.2 L SO3含有的分子数为0.5NA | |
| C. | 40gNaOH溶解在1L水中,所制得的100 mL溶液中含Na+数为0.1NA | |
| D. | 25℃、1.01×l05 Pa,64 g SO2中含有的原子数为3NA |
分析 A.氢气为双原子分子;
B.气体摩尔体积使用对象为气体;
C.40gNaOH溶解在1L水中,得到溶液体积大于1L;
D.质量转化为物质的量,结合1个二氧化硫分子含有3个原子解答.
解答 解:A.含有NA个原子的氢气物质的量为0.5mol,标状况下的体积约为11.2 L,故A错误;
B.标况下三氧化硫为固体,不能使用气体摩尔体积,故B错误;
C.40gNaOH溶解在1L水中,所制得的100 mL溶液中含Na+数小于0.1NA,故C错误;
D.64g二氧化硫的物质的量是1mol,含有3mol原子,含有的原子数为3NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确物质的量、粒子数、质量、体积等与阿伏加德罗常数关系是解题关键,注意标况下的气体摩尔体积的使用条件.

练习册系列答案
相关题目
4.下列哪种物质所含氢原子数与0.2molH3PO4所含氢原子数相等( )
| A. | 0.2molH2SO4 | B. | 0.4molH2O2 | C. | 0.6molHNO3 | D. | 0.8molNaCl |
5.元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是( )
| A. | 第IA族元素的金属性一定比第ⅡA族元素的金属性强 | |
| B. | 第VIIA族元素从上到下,其氢化物的还原性依次减弱 | |
| C. | 第三周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
2.下列对胶体的认识不正确的是( )
| A. | 光线透过胶体时,可产生丁达尔效应 | |
| B. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 | |
| C. | 胶体在一定的条件下也能稳定存在,属介稳体系 | |
| D. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水的目的 |
9. NH3是一种重要的化工原料,可以制备一系列物质(如图).下列说法正确的是( )
NH3是一种重要的化工原料,可以制备一系列物质(如图).下列说法正确的是( )
 NH3是一种重要的化工原料,可以制备一系列物质(如图).下列说法正确的是( )
NH3是一种重要的化工原料,可以制备一系列物质(如图).下列说法正确的是( )| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl、HNO3和Na2CO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的反应均为氧化还原反应 |
19.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,有关叙述正确的是( )
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼分子空间上是三角锥形 | |
| C. | 氯化硼熔点低是因为硼氯键键能较小 | |
| D. | 氯化硼属非极性分子 |
6.Mg(OH)2可用作塑料的阻燃剂.现以某矿石(主要成分为3MgO•2SiO2•2H2O,还有少量Fe2O3、FeO、CaO和Al2O3)为原料生产,其工艺流程如下:
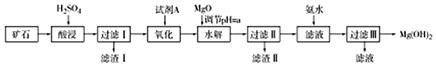
已知:
表1生成氢氧化物沉淀的pH
表2原料价格表
回答下列问题:
(1)酸浸时,为提高矿石的浸出率可采取的措施为将矿石粉碎(任写一条).该过程H2SO4适当过量的目的是使固体充分溶解、使Ca2+以CaSO4沉淀形式除去.
(2)工业生产要求生产成本较低,产品尽量不含杂质.试剂A的最佳选择是漂液(或NaClO),写出其发生反应的离子方程式2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)水解过程需调节溶液pH,a的取值范围为4.7≤a<9.1,滤渣II的成分是Fe(OH)3、Al(OH)3(填化学式).
(4)向过滤II所得滤液中加入一定量氨水,写出镁离子沉淀的离子方程式Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,该过程温度不宜过高的原因是氨水受热分解.
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法Mg(OH)2与盐酸反应生产MgCl2,蒸发浓缩冷却结晶得到MgCl2•6H2O晶体,在HCl气流中加热失水得到无水MgCl2,电解熔融的MgCl2制取金属Mg.

已知:
表1生成氢氧化物沉淀的pH
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)酸浸时,为提高矿石的浸出率可采取的措施为将矿石粉碎(任写一条).该过程H2SO4适当过量的目的是使固体充分溶解、使Ca2+以CaSO4沉淀形式除去.
(2)工业生产要求生产成本较低,产品尽量不含杂质.试剂A的最佳选择是漂液(或NaClO),写出其发生反应的离子方程式2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)水解过程需调节溶液pH,a的取值范围为4.7≤a<9.1,滤渣II的成分是Fe(OH)3、Al(OH)3(填化学式).
(4)向过滤II所得滤液中加入一定量氨水,写出镁离子沉淀的离子方程式Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,该过程温度不宜过高的原因是氨水受热分解.
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法Mg(OH)2与盐酸反应生产MgCl2,蒸发浓缩冷却结晶得到MgCl2•6H2O晶体,在HCl气流中加热失水得到无水MgCl2,电解熔融的MgCl2制取金属Mg.
4.n克的H2SO4所含氧原子的物质的量是( )
| A. | $\frac{n}{98}$moL | B. | $\frac{7n}{98}$moL | C. | $\frac{4n}{98}$moL | D. | $\frac{4n}{32}$moL |