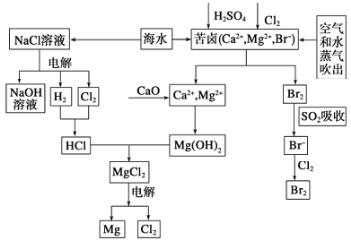
题目内容
【题目】聚合硫酸铁(简称PFS,化学式为[Fe(OH)n(SO4)3-n/2]m )是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁。实验步骤如下: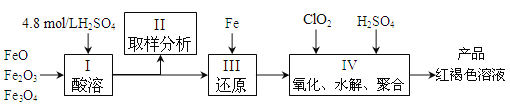
(1)实验室用18.4mol/L的浓硫酸配制250mL4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器__________。定容操作中若俯视容量瓶刻度线,所配硫酸溶液浓度将___________(填“偏高”、“偏低”或“无影响”)
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_______。
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化Fe2+时的离子方程式:____________________。(还原产物为Cl-)
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(I)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤,洗涤、干燥后,称重,其质量为mg。
(II)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL与0.1000 mol/L V mL KMnO4酸性溶液恰好完全反应,MnO4-被还原为Mn2+。
回答下列问题:
① 根据(II)步骤中判断Cu2+、Fe2+、MnO4-、Fe3+氧化性由强到弱的顺序:__________。
② 聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
【答案】(1)250mL容量瓶、胶头滴管;偏高(2)AC
(3)5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O
(4)①MnO4->Fe3+>Cu2+>Fe2+②(m/233):(V/200)
【解析】
试题分析:(1)实验室用18.4molL-1的浓硫酸配制250mL4.8molL-1的硫酸溶液,用量筒量取浓硫酸,在烧杯中溶解,并用玻璃棒搅拌,移入250mL容量瓶,最后需要用胶头滴管定容;定容操作中若俯视容量瓶刻度线,则容量瓶中溶液体积偏少,因此所配硫酸溶液浓度将偏高;
(2)由于控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需ClO2的量,答案选AC。
(3)酸性条件下,ClO2将Fe2+氧化为Fe3+,ClO2被还原为Cl-,反应离子方程式为5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O:
(4)①发生反应:Cu+2Fe3+=2Fe2++Cu2+,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,氧化剂氧化性强于氧化产物氧化性,氧化性由强到弱的顺序为MnO4->Fe3+>Cu2+>Fe2+;
②mg白色沉淀为BaSO4,由硫酸根守恒n(SO42-)=n(BaSO4)=m/233=mol,由原子守恒与电电子转移守恒可得关系式:5Fe3+~5Fe2+~MnO4-,则n(Fe3+)=5n(MnO4-)=5×V×10-3L×0.1mol/L×250mL/25mL,n(SO42-):n(Fe3+)=m/233mol:5×V×10-3L×0.1mol/L×250mL/25mL=(m/233):(V/200)。