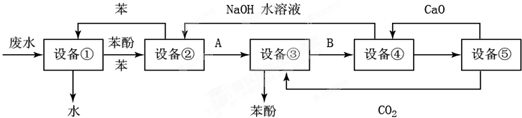
题目内容
 如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为
(3)写出G→A+C的化学方程式:
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目:
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中A、E、H2SO4的物质的量之比为
考点:无机物的推断
专题:推断题
分析:其中A俗称铁红,化学式为Fe2O3;甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀判断为Fe(OH)3,C为H2O;I的颜色呈浅绿色,为亚铁离子的溶液,(1)若F是由Na+和SO42-组成的溶液,则依据转化关系得到,甲为强酸H2SO4;A为Fe2O3;依据氧化铁的性质分析应用和用途;
(2)若D是能使澄清石灰水变浑浊的气体,判断乙为还原性气体CO,还原氧化铁为铁和二氧化碳气体,E为Fe,铁和丁反应生成亚铁离子证明丁为稀酸;亚铁离子和碱氢氧化钠反应生成白色沉淀氢氧化亚铁,在空气中 会被迅速氧化为氢氧化铁红褐色沉淀;
(3)变化为氢氧化铁受热分解生成氧化铁和水的反应;
(4)铁与水反应生成四氧化三铁与氢气;
(5)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液;
(6)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;
依据反应Fe+2H+=Fe2++H2↑;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+2Fe3+=3Fe2+分析计算.
(2)若D是能使澄清石灰水变浑浊的气体,判断乙为还原性气体CO,还原氧化铁为铁和二氧化碳气体,E为Fe,铁和丁反应生成亚铁离子证明丁为稀酸;亚铁离子和碱氢氧化钠反应生成白色沉淀氢氧化亚铁,在空气中 会被迅速氧化为氢氧化铁红褐色沉淀;
(3)变化为氢氧化铁受热分解生成氧化铁和水的反应;
(4)铁与水反应生成四氧化三铁与氢气;
(5)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液;
(6)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;
依据反应Fe+2H+=Fe2++H2↑;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+2Fe3+=3Fe2+分析计算.
解答:
解:其中A俗称铁红,化学式为Fe2O3;甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀判断为Fe(OH)3,C为H2O;I的颜色呈浅绿色,为亚铁离子的溶液,
(1)若F是由Na+和SO42-组成的溶液,则依据转化关系得到,甲为强酸H2SO4;A为Fe2O3;氧化铁的性质分析应用和用途,铁红是非常重要的一种防锈颜料,绝大多数的涂料都开发有铁红防锈漆,如醇酸铁红防锈漆、氯化橡胶铁红防锈漆和环氧铁红防锈漆.甚至在某些环氧富锌底漆中,都以铁红作为重要辅助防锈颜料;故答案为:H2SO4;用作红色油漆和涂料;
(2)若D是能使澄清石灰水变浑浊的气体,判断乙为还原性气体CO,还原氧化铁为铁和二氧化碳气体,E为Fe,铁和丁反应生成亚铁离子证明丁为稀酸;亚铁离子和碱氢氧化钠反应生成白色沉淀氢氧化亚铁,在空气中会被迅速氧化为氢氧化铁红褐色沉淀;反应的离子方程式和化学方程式为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:CO;酸;生成白色沉淀,迅速变为灰绿色,最终变为红褐色;Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G→A+C的化学方程式变化为氢氧化铁受热分解生成氧化铁和水的反应;反应化学方程式为:2Fe(OH)3
Fe2O3+3H2O;
故答案为:2Fe(OH)3
Fe2O3+3H2O;
(4)铁与水反应生成四氧化三铁与氢气,Fe失去电子,H得到电子,表示式为 ,故答案为:
,故答案为: ;
;
(5)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液,不溶于强碱溶液,加入过量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解;反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O;
(6)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;
依据反应:Fe+H2SO4=Fe2++H2↑;
1 1 1 1
Fe+2Fe3+=3Fe2+;
1 2 3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
1 3 1
反应物中Fe2O3、Fe、H2SO4的物质的量之比=1:2:4,
故答案为:1:2:4.
(1)若F是由Na+和SO42-组成的溶液,则依据转化关系得到,甲为强酸H2SO4;A为Fe2O3;氧化铁的性质分析应用和用途,铁红是非常重要的一种防锈颜料,绝大多数的涂料都开发有铁红防锈漆,如醇酸铁红防锈漆、氯化橡胶铁红防锈漆和环氧铁红防锈漆.甚至在某些环氧富锌底漆中,都以铁红作为重要辅助防锈颜料;故答案为:H2SO4;用作红色油漆和涂料;
(2)若D是能使澄清石灰水变浑浊的气体,判断乙为还原性气体CO,还原氧化铁为铁和二氧化碳气体,E为Fe,铁和丁反应生成亚铁离子证明丁为稀酸;亚铁离子和碱氢氧化钠反应生成白色沉淀氢氧化亚铁,在空气中会被迅速氧化为氢氧化铁红褐色沉淀;反应的离子方程式和化学方程式为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:CO;酸;生成白色沉淀,迅速变为灰绿色,最终变为红褐色;Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G→A+C的化学方程式变化为氢氧化铁受热分解生成氧化铁和水的反应;反应化学方程式为:2Fe(OH)3
| ||
故答案为:2Fe(OH)3
| ||
(4)铁与水反应生成四氧化三铁与氢气,Fe失去电子,H得到电子,表示式为
 ,故答案为:
,故答案为: ;
;(5)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液,不溶于强碱溶液,加入过量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解;反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O;
(6)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;
依据反应:Fe+H2SO4=Fe2++H2↑;
1 1 1 1
Fe+2Fe3+=3Fe2+;
1 2 3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
1 3 1
反应物中Fe2O3、Fe、H2SO4的物质的量之比=1:2:4,
故答案为:1:2:4.
点评:本题考查了物质转化关系的分析判断,物质性质的应用,主要是铁、铝及其化合物性质的分析应用,题目难度中等.

练习册系列答案
相关题目
根据有机化合物的命名原则,下列命名正确的是( )
A、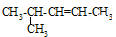 2-甲基-3-戊烯 |
B、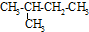 异丁烷 |
| C、CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| D、CH3CH(NO2)CH2COOH 3-硝基丁酸 |
用括号内的试剂除去下列各组物质中含有的少量杂质,正确的是( )
| A、溴苯中的溴(NaOH溶液,分液) |
| B、乙酸乙酯中的乙醇(乙酸,分液) |
| C、苯中的苯酚(浓溴水,过滤) |
| D、乙醇中的乙酸(饱和Na2CO3溶液,分液) |
可用来鉴别己烯、甲苯、乙酸乙酯和苯酚溶液的一组试剂是( )
| A、浓溴水、氯化铁溶液 |
| B、浓溴水、酸性高锰酸钾溶液 |
| C、浓溴水、碳酸钠溶液 |
| D、氯化铁溶液、酸性高锰酸钾溶液 |
反应2A(g)?2B(g)+C(g);△H>0,达平衡时,要使v正降低、c(A)增大,应采取的措施是( )
| A、减小容器体积 | B、扩大容器体积 |
| C、加催化剂 | D、降温 |
下列各组元素各项性质比较正确的是( )
| A、第一电里能:O>N>C |
| B、熔点:食盐>冰>碘 |
| C、电负性:O>C>Si |
| D、半径:K+>Cl->F- |