��Ŀ����
����Ŀ������Ͻ�ThNi5�ɴ���CO��H2�ϳ�CH4���л�������Ʒ�ķ�Ӧ���¶�ΪTKʱ�������·�Ӧ����
��![]()
��![]()
��![]()
��![]()
��l���¶�ΪTKʱ������CO��H2�ϳ�CH4��Ӧ���Ȼ�ѧ����ʽΪ____��
��2����֪�¶�ΪTKʱ![]() �Ļ��Ϊ485.2 kJ/mol�������淴Ӧ�Ļ��Ϊ____kJ/mol��
�Ļ��Ϊ485.2 kJ/mol�������淴Ӧ�Ļ��Ϊ____kJ/mol��
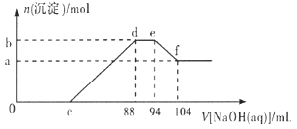
��3��TKʱ����һ��ѹ�ܱ������г�������ʵ�����CO(g)��H2O(g)����������Ӧ�ڣ����ų�������Ӧ���ţ������CO(g)���ʵ���������ʱ��仯���±���ʾ��

����ʼͶ��COΪ2 mol����ѹ�����ݻ�10 L����H2O(g)��ʾ�÷�Ӧ0-5�����ڵ�����v��H2O��g����=____��6����ʱ�����ı�һ�������ƻ���ƽ�⣬��ı���������Ϊ____
��4��750K�£��ں����ܱ������У�����һ�����ļ״���������Ӧ�ܣ�����ʼѹǿΪ101 kPa���ﵽƽ��ת����Ϊ50. 0%����Ӧ��ƽ�ⳣ��Kp= _____��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ����
��5��ij�¶��£���2 mol CO��5 mol H2�Ļ����������ݻ�Ϊ2L���ܱ������У��ڴ����������·�����Ӧ�ۡ�����5 min��Ӧ�ﵽƽ�⣬��ʱת�Ƶ���6 mol��������������䣬�ٳ���2 mol CO��1.5 mol CH3OH����ʱv������____v���棩������>�� ��<������=���������в���˵���÷�Ӧ�Ѵﵽƽ��״̬����____��
a CH3OH���������� b ��������ƽ����Է����������ٸı�
c v��(CO)=2v��(H2) d ��������ܶȲ��ٷ����ı�
��6����֪400 K��500 Kʱˮú���任��CO��H����ѹ��ʱ��仯��ϵ����ͼ��ʾ������Ϊ��������ʵ���ʼʱ��ϵ�е�pH2O��PCO��ȡ�PCO2��pH2��ȣ���֪700 Kʱ![]() ��K=l. 31��
��K=l. 31��

400 KʱpH2��ʱ��仯��ϵ�������� _____500 KʱpCO��ʱ��仯��ϵ��������____
���𰸡�![]() 320.2 0.32molL-1mim-1 �����¶� 50.5 kPa > cd b d
320.2 0.32molL-1mim-1 �����¶� 50.5 kPa > cd b d
��������
(l)�ɸ�˹���ɿ�֪����-�ٵõ�![]() ���Դ������
���Դ������
(2)��Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�������������֪��Ϣ��![]() Ϊ���ȷ�Ӧ����Ӧ�����������������������������ݷ�Ӧ������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��-��Ӧ���ʱ䣻
Ϊ���ȷ�Ӧ����Ӧ�����������������������������ݷ�Ӧ������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��-��Ӧ���ʱ䣻
(3)������Ӧ![]() ������v=
������v=![]() ���㷴Ӧ���ʣ���������֮�ȵ��ڷ�Ӧ�м�����֮�ȿɵõ�H2O�ķ�Ӧ���ʣ����ݱ��е����ݿ�֪����5���Ӻ�һ����̼�����ʵ�����������Ϊ0.1������Ӧ�ﵽƽ��״̬���÷�Ӧ����������ʵ������䣬6����ʱ��һ����̼�����ʵ���������С��˵��ƽ�������ƶ����ݴ˷�����
���㷴Ӧ���ʣ���������֮�ȵ��ڷ�Ӧ�м�����֮�ȿɵõ�H2O�ķ�Ӧ���ʣ����ݱ��е����ݿ�֪����5���Ӻ�һ����̼�����ʵ�����������Ϊ0.1������Ӧ�ﵽƽ��״̬���÷�Ӧ����������ʵ������䣬6����ʱ��һ����̼�����ʵ���������С��˵��ƽ�������ƶ����ݴ˷�����
(4)��״������ʵ���Ϊ1mol��ƽ��ʱת����Ϊ50%�����������ʽ��������ƽ��ʱ��ѹ�ͷ�ѹ�Ĺ�ϵ���㣻
(5)ij�¶ȣ���2molCO��5molH2�Ļ����������ݻ�Ϊ2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬���ݻ�ѧ����ʽ��֪ת�Ƶ���4mol����CO���ʵ���Ϊ1mol�����ʱת�Ƶ���6mol������CO���ʵ���=![]() ��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ����ƽ�ⳣ��K=
��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ����ƽ�ⳣ��K=![]() ��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc��ƽ�ⳣ����С�Ƚ��ж�ƽ��Ľ��з���Ӧ�����������С�ķ��ȷ�Ӧ����Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣬����ѡ���б�������˵����Ӧ�ﵽƽ��״̬�������ܴﵽƽ�⣻
��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc��ƽ�ⳣ����С�Ƚ��ж�ƽ��Ľ��з���Ӧ�����������С�ķ��ȷ�Ӧ����Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣬����ѡ���б�������˵����Ӧ�ﵽƽ��״̬�������ܴﵽƽ�⣻
(6)�÷�ӦΪ���ȷ�Ӧ����С��700Kʱ��K(400K)> K(500K)>1.31����ƽ��ʱp(H2)> p(CO)����a��b��ʾH2�ķ�ѹ��c��d��ʾCO�ķ�ѹ��
(1)��֪��Ӧ����![]() ����
����![]() ���ɸ�˹���ɿ�֪����-�ٵõ�
���ɸ�˹���ɿ�֪����-�ٵõ�![]() ��
��
�ʴ�Ϊ��![]() ��
��
(2)��Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�������������֪��Ϣ��![]() Ϊ���ȷ�Ӧ����Ӧ�����������������������������ݷ�Ӧ������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��-��Ӧ���ʱ䣻
Ϊ���ȷ�Ӧ����Ӧ�����������������������������ݷ�Ӧ������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��-��Ӧ���ʱ䣻![]() ���÷�Ӧ�Ļ��Ϊ485.2 kJ/mol�������淴Ӧ�Ļ��=485.2 kJ/mol -165 kJ/mol =320.2 kJ/mol��
���÷�Ӧ�Ļ��Ϊ485.2 kJ/mol�������淴Ӧ�Ļ��=485.2 kJ/mol -165 kJ/mol =320.2 kJ/mol��
(3)������Ӧ![]() ������ʼͶ��һ����̼Ϊ2mol����ˮ����ҲΪ2mol���÷�Ӧ�������ʵ������䣬����ƽ��ʱһ����̼�����ʵ���Ϊ4mol��0.1=0.4mol��0��5�����ڵ�һ����̼�ķ�Ӧ��������CO��=
������ʼͶ��һ����̼Ϊ2mol����ˮ����ҲΪ2mol���÷�Ӧ�������ʵ������䣬����ƽ��ʱһ����̼�����ʵ���Ϊ4mol��0.1=0.4mol��0��5�����ڵ�һ����̼�ķ�Ӧ��������CO��= =0.032mol/��Lmin����6����ʱ��һ����̼�����ʵ���������С��˵��ƽ�������ƶ������÷�ӦΪ���ȷ�Ӧ������ӦΪ�����¶ȣ�
=0.032mol/��Lmin����6����ʱ��һ����̼�����ʵ���������С��˵��ƽ�������ƶ������÷�ӦΪ���ȷ�Ӧ������ӦΪ�����¶ȣ�
(4)��״������ʵ���Ϊ1mol��ƽ��ʱת����Ϊ50%�����������ʽ��

nʼ��nƽ=![]()
��Ӧ��ƽ�ⳣ��Kp= =50.5 kPa��
=50.5 kPa��
(5)ij�¶ȣ���2molCO��5molH2�Ļ����������ݻ�Ϊ2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬���ݻ�ѧ����ʽ��֪ת�Ƶ���4mol����CO���ʵ���Ϊ1mol�����ʱת�Ƶ���6mol������CO���ʵ���==![]() ��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ����:
��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ����:

ƽ��Ũ��c(CO)=![]() =0.25mol/L��c(H2)=
=0.25mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() =0.75mol/L��ƽ�ⳣ��K=
=0.75mol/L��ƽ�ⳣ��K=![]() =3��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc=
=3��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc= =1.2<3��˵��ƽ��������У���ʱv(��)>v(��)��
=1.2<3��˵��ƽ��������У���ʱv(��)>v(��)��
CO(g)+2H2(g)CH3OH(g)��H<0����Ӧ�����������С�ķ��ȷ�Ӧ����Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣬����ѡ���б�������˵����Ӧ�ﵽƽ��״̬��
a.CH3OH���������䣬���ʵ������䣬˵����Ӧ�ﵽƽ��״̬����a���������⣻
b.��Ӧǰ�������������䣬��Ӧǰ���������ʵ����仯������������ƽ����Է����������ٸı䣬˵����Ӧ�ﵽƽ��״̬����b���������⣻
c.��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�2v��(CO)=v��(H2) ����������Ӧ����֮�ȣ�������2v��(CO)=v��(H2)˵�����������淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬����v��(CO)=2v��(H2)����˵����Ӧ�ﵽƽ��״̬����c�������⣻
d.��Ӧǰ�������������䣬����������䣬���������ܶ�ʼ�ղ������ı䣬����˵����Ӧ�ﵽƽ��״̬����d�������⣻
�ʴ�Ϊcd��
(6)��֪700 Kʱ![]() ��K=l. 31���÷�ӦΪ���ȷ�Ӧ����С��700Kʱ��K(400K)> K(500K)>1.31����ƽ��ʱp(H2)> p(CO)����a��b��ʾH2�ķ�ѹ��c��d��ʾCO�ķ�ѹ�������¶ȷ�Ӧ������У�CO�ķ�ѹ����H2�ķ�ѹ��С�����ɴ˿��ж�400Kʱp(H2)�� p(CO)��ʱ��仯��ϵ���߷ֱ���b��c��500Kʱp(H2)�� p(CO)��ʱ��仯��ϵ���߷ֱ���a��d��
��K=l. 31���÷�ӦΪ���ȷ�Ӧ����С��700Kʱ��K(400K)> K(500K)>1.31����ƽ��ʱp(H2)> p(CO)����a��b��ʾH2�ķ�ѹ��c��d��ʾCO�ķ�ѹ�������¶ȷ�Ӧ������У�CO�ķ�ѹ����H2�ķ�ѹ��С�����ɴ˿��ж�400Kʱp(H2)�� p(CO)��ʱ��仯��ϵ���߷ֱ���b��c��500Kʱp(H2)�� p(CO)��ʱ��仯��ϵ���߷ֱ���a��d��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�