题目内容
5.如图图示与对应的叙述相符的是( )
| A. | 图甲表示反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
分析 A、由图甲可知,CO的起始物质的量相同时,该反应为放热反应,降低温度平衡向正反应移动,温度越低,氮气的含量更高,故温度T1<T2,据此解答;
B、压强的改变不仅影响反应速率,而且平衡也发生移动;
C、催化剂只影响反应速率,不影响焓变;
D、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应.
解答 解:A、由图甲可知,CO的起始物质的量相同时,该反应为放热反应,降低温度平衡向正反应移动,温度越低,氮气的含量更高,故温度T1<T2,温度越高化学平衡越低,故K1>K2,故A错误;
B、对于2A(g)+2 B(g)?3C(g)+D(g),压强的改变不仅影响反应速率,而且平衡也发生移动,故B错误;
C、催化剂不影响反应的焓变,故C错误;
D、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应,所以该反应的△H<0,故D正确;
故选D.
点评 本题考查了化学平衡图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
10.25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4.下列说法正确的是( )
| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |
17.化学与生产生活息息相关.下列说法不正确的是( )
| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
14.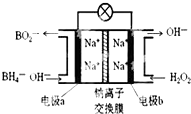 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
12.文献报道某课题组利用CO2催化氢化制甲烷的研究过程如图1:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )
| A. | 反应Ⅰ的速率增加,反应Ⅱ的速率不变 | |
| B. | 反应Ⅰ的速率不变,反应Ⅱ的速率增加 | |
| C. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 | |
| D. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |

 电量为(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可)。
电量为(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可)。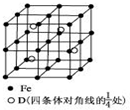 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.

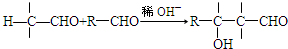

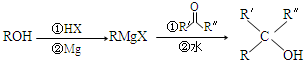
 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式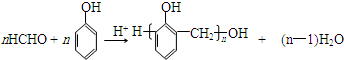 .
.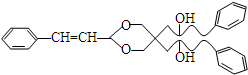 .
. .
.