题目内容
【题目】常温下,关于溶液的稀释说法正确的是( )
A.将1 L 0.1molL﹣1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10﹣6molL﹣1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
【答案】A
【解析】解:A.将1 L 0.1molL﹣1的Ba(OH)2溶液加水稀释为2L,溶液中C(OH﹣)= ![]() =0.1mol/L,则C(H+)=
=0.1mol/L,则C(H+)=
10﹣13 mol/L,所以pH=13,故A正确;
B.如果醋酸是强电解质,则pH=3的醋酸溶液加水稀释100倍,pH=5,实际上醋酸是弱电解质,所以稀释后pH<5,故B错误;
C.将pH=4的H2SO4加水稀释100倍,则溶液的pH=6,溶液中C(OH﹣)=1×10﹣8molL﹣1 , 所以溶液中由水电离产生的C(H+)=1×10﹣8molL﹣1 , 故C错误;
D.将pH=8的NaOH溶液加水稀释100倍,溶液仍然是碱性溶液不可能是酸性溶液,其溶液的pH>7,故D错误;
故选A.
A.先计算稀释后溶液中氢氧根离子浓度,再计算溶液中氢离子浓度,从而确定溶液的pH;
B.醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释能促进醋酸电离;
C.先计算稀释后溶液中氢离子浓度,再结合水的离子积常数计算水电离出的氢氧根离子浓度,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度;
D.酸或碱无论如何稀释都不能转变为碱或酸.

 阅读快车系列答案
阅读快车系列答案【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有(填序号,下同). A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是 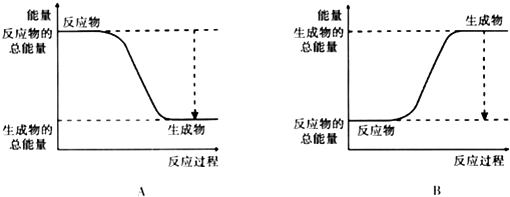
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
化学键 | H﹣H | O=O | H﹣O |
键能kJmol﹣1 | 436 | 496 | 463 |
由此计算2mol H2在氧气中燃烧生成气态水放出的热量 .