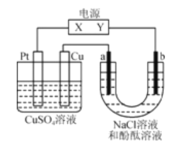
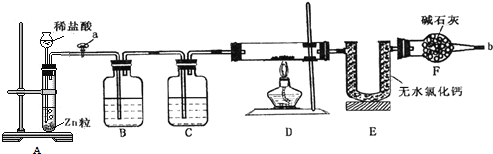
题目内容
【题目】某充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4 ![]() LiMn2O4,某手机镍氢电池总反应为: NiOOH+MH ==== M+Ni(OH)2(M为充电储氧金属或合金),有关上述两种电池的说法不正确的是( )
LiMn2O4,某手机镍氢电池总反应为: NiOOH+MH ==== M+Ni(OH)2(M为充电储氧金属或合金),有关上述两种电池的说法不正确的是( )
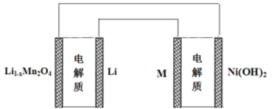
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极的电极反应式NiOOH+H2O+e-Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式LiMn2O4-xe-=Li1-xMn2O4+xLi+
【答案】D
【解析】
A.锂离子电池放电时阳离子移向正极,所以Z向正极迁移,选项A正确;
B.放电时,正极发生还原反应,方程式为NiOOH+e-+H2O=Ni(OH)2+OH-,选项B正确;
C.图表示用锂离子电池为放电过程,而镍氧氯电池为充电过程,所以锂离子电池给镍电池充电,选项C正确;
D.锂离子电池充电时,阴极的电极反应式: Li++e-═Li,选项D错误。
答案选D。

【题目】 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______(填元素名称)。
(2)以上元素中,属于s区的元素有_____种,属于d区的元素有______种。
(3)第一电离能I1(Cr)________I1(Co)(填“>”、“<”或“=”,下同)。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。