题目内容
可逆反应N2(g)+3H2(g)?2NH3(g),500℃时在容积为10L的密闭容器中进行,开始时加入1mol N2和6mol H2,则达到平衡时,NH3的浓度不可能达到( )
分析:依据反应是可逆反应,不能进行彻底分析计算判断,可以利用极值法分析.
解答:解:N2(g)+3H2(g)?2NH3(g),依据极值法计算分析,若氮气和氢气全部反应则:1molN2和6mol氢气反应,根据化学方程式计算可知,氢气过量,氮气全部反应生成氨气物质的量为2mol,c(NH3)=
=0.2mol/L,因为反应是可逆反应,不可能进行彻底,所以反应过程中生成的氨气浓度小于0.2mol/L,
选项中A、C、D有可能生成,而B不能达到,
故选:B.
| 2mol |
| 10L |
选项中A、C、D有可能生成,而B不能达到,
故选:B.
点评:本题考查了可逆反应的特征应用,建立化学平衡,反应不能进行彻底,极值假设假设是解题的常用方法,题目难度中等.

练习册系列答案
相关题目
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )
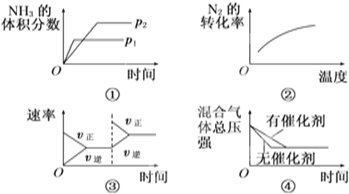

| A、①压强对反应的影响(p2>p1) | B、②温度对反应的影响 | C、③平衡体系增加N2对反应的影响 | D、④催化剂对反应的影响 |
 2NH3(g)(放热反应)的下列条件后,有关的叙述中错误的是( )
2NH3(g)(放热反应)的下列条件后,有关的叙述中错误的是( )