题目内容
4.用稀盐酸预处理强酸型阳离子交换树脂,使之变为HR,再用蒸馏水洗涤至中性,然后用该树脂软化100mL含0.001molMg2+的中性溶液,使Mg2+完全被树脂所交换,再用100mL蒸馏水洗涤树脂.将交换液和洗涤液收集到一起,该混合液的pH为( )| A. | 2.0 | B. | 2.3 | C. | 3.0 | D. | 7.0 |
分析 2HR+Mg2+═MgR2+2H+,根据方程式计算氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子浓度,pH=-lgc(H+)据此分析解答.
解答 解:100mL含0.001molMg2+的中性溶液,n(Mg2+)=1×10-3mol,2HR+Mg2+═MgR2+2H+,应交换出2×10-3molH+,混合溶液体积=100mL+100mL=200mL,所以c(H+)=$\frac{n}{V}$=$\frac{2×1{0}^{-3}mol}{0.2L}$=1×10-2mol/L,pH=-lgc(H+)=2,
故选A.
点评 本题考查了pH的简单计算,明确离子交换树脂交换原理是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.已知:S(l)+O2(g)=SO2(g)△H=-293.23kJ•mol-1,分析下列说法中正确的是( )
| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
12.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | HCl气体溶于水 |
9.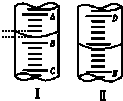 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2 mL,Ⅱ中是9.40 mL | B. | Ⅰ中是10.8 mL,Ⅱ中是9.40 mL | ||
| C. | Ⅰ中是9.2 mL,Ⅱ中是10.60 mL | D. | Ⅰ中是10.8 mL,Ⅱ中是10.60 mL |
16.下列递变情况中不正确的是( )
| A. | 碳、氮、氧、氟的原子半径依次增大 | |
| B. | 硅、磷、硫、氯元素的最高正化合价依次升高 | |
| C. | 钠、镁、铝原子的最外层电子数依次增多 | |
| D. | 锂、钠、钾、铷的金属性依次增强 |
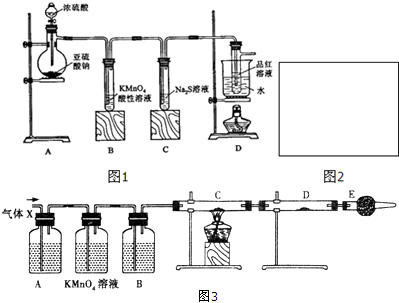
 或
或 .
. 、
、 、
、 .
.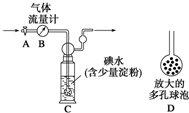 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案: