题目内容
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则N2(g)+3H2(g)=2NH3(g) ΔH=______________
Ⅱ.下图是镁铝原电池请写出甲的电池总反应______________ ,乙池铝极的电极反应式______________

Ⅲ.下图是一个化学过程的示意图,回答下列问题:

(1)乙装置中电极A的名称是__________
(2)甲装置中通入CH4的电极反应式为 ________________________________________________
(3)一段时间,当丙池中产生224 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为1000 mL)。
【答案】-92.4 kJ·mol-1 Mg+2H+ =Mg2+ +H2↑ 2Al-6e-+8OH-=2AlO2-+4H2O 阳极 CH4+10OH--8e-=CO32-+7H2O 12
【解析】
Ⅰ.(1)反应的焓变△H=反应物键能总和-生成物键能总和计算;
Ⅱ. 镁铝原电池,图甲中,电解质溶液为硫酸,则根据金属活动性顺序判断电源负极为镁,图乙中,电解质溶液为氢氧化钠,铝与氢氧化钠发生自发的氧化还原反应,故铝做负极,据此分析作答;
Ⅲ. (1)甲池为甲烷形成的燃料电池;根据原电池的正负极判断乙装置电解池的阴阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根;
(3)电解氯化钠溶液时,阴极上氢离子放电,阳极上氯离子放电,根据氯气、氢气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH。
Ⅰ. N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1,N2(g)+3H2(g)=2NH3(g) ΔH=反应物键能总和生成物键能总和 = 948.9 kJmol1+3×436.0 kJmol16×391.55 kJmol1 =-92.4 kJ·mol-1,
故答案为:-92.4 kJ·mol-1;
Ⅱ. 图甲的原电池装置中,镁做负极,被氧化,铝电极做正极,氢离子被还原,其总的电池反应式为:Mg+2H+ =Mg2+ +H2↑;在图乙中,铝与氢氧化钠溶液反应,Al为原电池的负极,被氧化,故电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O,
故答案为:Mg+2H+ =Mg2+ +H2↑;2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅲ. (1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A的名称为阳极;
故答案为:阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(3)丙池中发生的反应为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,丙池中产生224 mL,则氢气的体积与氯气的体积相同均为112 mL,其物质的量为
2NaOH+H2↑+Cl2↑,丙池中产生224 mL,则氢气的体积与氯气的体积相同均为112 mL,其物质的量为![]() = 0.005 mol,根据H2
= 0.005 mol,根据H2![]() 2NaOH关系式得n(NaOH)=2×0.005 mol = 0.01 mol,故c(OH-) =
2NaOH关系式得n(NaOH)=2×0.005 mol = 0.01 mol,故c(OH-) = ![]() = 0.01 mol/L,根据水的离子积c(H+) =
= 0.01 mol/L,根据水的离子积c(H+) = ![]() = 10-12 mol/L,所以溶液的pH=12,
= 10-12 mol/L,所以溶液的pH=12,
故答案为:12。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
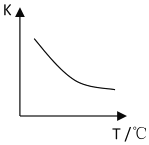
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。




