题目内容
下图是实验室中制备气体或验证气体性质的装置图
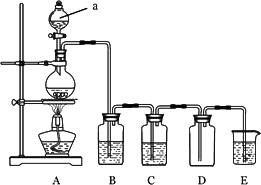
(1)仪器a的名称是________.
(2)利用上图装置制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的离子方程式为________.
②装置B中的溶液为________;烧杯中溶液的作用为________.
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有漂白性和还原性
实验2:证明碳元素的非金属性比硅元素的强
①B中为少量品红溶液,C中为少量酸性KMnO4溶液,则证明SO2具有漂白性的现象为________.
②D中应加入足量的________(填溶液名称),E中加入________(填溶液名称),证明碳元素的非金属性比硅元素的强的现象为________.
③为提高实验2的准确性,必须改进的装置为________.(填装置代号)
解析:
|
(1)分液漏斗 (2)①MnO2+4H++Cl-=Mn2++Cl2↑+H2O ②饱和食盐水;吸收多余的氯气,防止污染空气 (3)①B中品红溶液褪色 ②酸性高锰酸钾溶液,硅酸钠溶液,D中高锰酸钾溶液不褪色,E中溶液变浑浊 ③E |

二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 | 色态 | 挥发性 | 熔点 | 沸点 |
| 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | 300 ℃以上完全分解 | |||
| S2Cl2+Cl2 | ||||
| 遇水反应生成SO2、S等产物 |
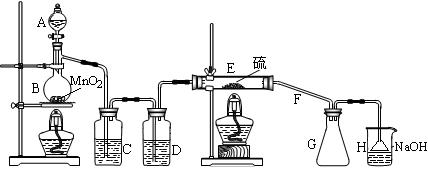
向熔融的硫中通以干燥、纯净的C12即可生成S2C12。下图是实验室制备S2Cl2的装置。
(1)仪器A的名称是 ,导管F除导气外还起的作用是 ;
(2)B中反应的离子方程式为 ;
(3)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分
液漏斗活塞没有堵塞,你认为应采取的措施是 ;
(4)装置C中的试剂是 ;如果缺少D装置,则对实验的影响是(用化学方程式表示) ;
(5)如果在加热E时温度过高,对实验结果的影响是 ;为了提高S2C12的纯度,关键的操作是控制好温度和 。
(6)设计装置H的目的是 ;烧杯中发生反应的离子方程式
是 。
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 | 色态 | 挥发性 | 熔点 | 沸点 |
| 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | 300 ℃以上完全分解 | |||
S2Cl2+Cl2 2SCl2 2SCl2 | ||||
| 遇水反应生成SO2、S等产物 | ||||
(1)仪器A的名称是 ,导管F除导气外还起的作用是 ;
(2)B中反应的离子方程式为 ;
(3)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分
液漏斗活塞没有堵塞,你认为应采取的措施是 ;
(4)装置C中的试剂是 ;如果缺少D装置,则对实验的影响是(用化学方程式表示) ;
(5)如果在加热E时温度过高,对实验结果的影响是 ;为了提高S2C12的纯度,关键的操作是控制好温度和 。
(6)设计装置H的目的是 ;烧杯中发生反应的离子方程式
是 。
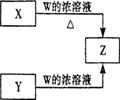

 (3)
(3) 
