题目内容
100 ml H2S、O2的混合气,点爆后恢复到原状况,气体体积变为25 ml,求原混合气体中H2S、O2各占多少ml。
答案:
解析:
解析:
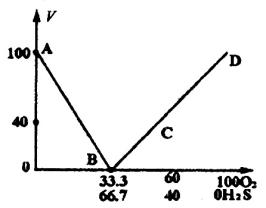
当余25 mL全是SO2时,V(H2S)=50 mL,V(O2)=50 mL余;25 mL全是H2S时,V(H2S)=75 mL, V(O2)=25 mL。 绘制图(下图)。若全部是 应用:从图象可见,本题任何情况下都有二组解(除反应后气体体积为0),有以下三种情况:当反应后气体体积V(下同)>40mL时,反应后气体是过量的H2S或SO2与过量O2的混合气,当V=40mL时,反应后气体是过量的H2S或SO2(还有固体生物S),本题的解是属于这种情况,即一部分H2S燃烧生成SO2和H2O,一部分H2S燃烧生成S和H2O。 综上可见,图象可以使我们对解的范围明朗,克服了逐组讨论的繁琐,有时还可以避免逐组讨论由于疏忽造成错误,若设O2过量,设H2S为xmL,O2为ymL。 2 SO2+2H2O
解得x=50,y=50,其实这组解是不成立的,因为各占50mL时,O2并不过量。
|

练习册系列答案
相关题目
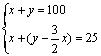
 标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,不正确的是( )