题目内容
短周期主族元素A、B、C、D的原子序数依次增大。A是周期表中原子半径最小的元素,B是周期表中能形成化合物最多的元素,C2-和D3+离子的电子层结构相同。下列说法正确的是
A. 氢化物的稳定性:B>C
B. 简单离子的半径:D>C
C. 最高价氧化物对应的水化物的酸性:B>D
D. A、B、C、D形成的单质最多有6种
练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
14.已知下列物质的氧化性强弱的顺序为Cl2>FeCl3>I2>H2SO4,判断下列化学反应不能发生的是( )
| A. | I2+SO2+2H2O═H2SO4+2HI | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | 2FeCl3+2HI═2FeCl2+2HCl+I2 | D. | FeCl2+I2═FeI2+Cl2 |
12.将等物质的量的SO2和Cl2混合均匀后,通入以下溶液.下列说法不正确的是( )
| A. | 品红溶液褪色 | B. | AgNO3溶液产生沉淀 | ||
| C. | BaCl2溶液产生沉淀 | D. | 石蕊试液变红 |


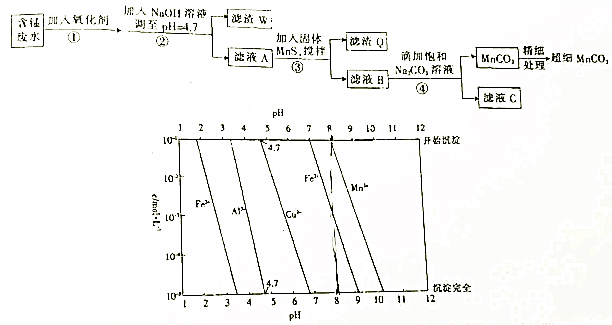
 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。


 B.物质的量浓度c=
B.物质的量浓度c= 
 D.溶液密度
D.溶液密度 =
=