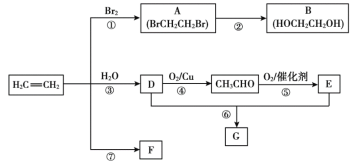
题目内容
【题目】在恒容的密闭容器中充入适量NO2,发生如下反应:2NO2(g) ![]() N2O4(g),当分离出部分N2O4时,下列说法中正确的是( )
N2O4(g),当分离出部分N2O4时,下列说法中正确的是( )
A. υ(正)增大B. 平衡逆向移动C. υ(正)>υ(逆)D. NO2转化率不变
【答案】C
【解析】
恒容的密闭容器中充入适量NO2,发生反应2NO2(g)N2O4(g),当分离出部分N2O4时,瞬间NO2的浓度不变,N2O4的浓度减小,平衡正向移动,υ(正)>υ(逆),正反应速率在减小,直到正逆反应速率相等,以此来解答。
A.分离出部分N2O4时,瞬间NO2的浓度不变,N2O4的浓度减小,平衡正向移动,υ(正)>υ(逆),正反应速率在减小,直到正逆反应速率相等,故A错误;
B.减小生成物的浓度,平衡正向移动,故B错误;
C.由A可知,减小生成物浓度,平衡正向移动,υ(正)>υ(逆),故C正确;
D.因平衡向正反应方向移动,则NO2转化率增大,故D错误;
答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目