题目内容
4.高温下一定量的甲烷分解得到C2H2、H2及未分解的甲烷的混合气体,且该混合气体的平均相对分子质量为10,则甲烷的分解率为( )| A. | 90% | B. | 80% | C. | 70% | D. | 60% |
分析 令甲烷的物质的量为1mol,设分解的甲烷为xmol,根据方程式计算反应后混合气体的总的物质的量,根据质量守恒可知,反应后混合气体的质量等于起始甲烷的质量,根据m=nM计算出甲烷分解的物质的量,再求出分解率.
解答 解:令甲烷的物质的量为1mol,设分解的甲烷为xmol,则:
2CH4→C2H2+3H2 气体物质的量增大
2 2
xmol xmol
故反应后气体的总的物质的量为1mol+xmol,
故反应后混合气体的平均摩尔质量=$\frac{1mol×16g/mol}{(1+x)mol}$=10g/mol,
则x=0.6
则甲烷的分解率为$\frac{0.6mol}{1mol}$×100%=60%,
故选D.
点评 本题考查混合物的有关计算,难度不大,根据方程式计算反应后混合气体的总的物质的量是关键,注意把握公式的应用.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
12.在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)?CH3OH(g)十H2O(g)△H=-25k/mol.已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等.下列分析正确的是( )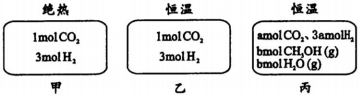

| A. | 刚开始反应时速率:甲>乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
17.甘油( )与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )
)与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )
 )与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )
)与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )| A. | 16种 | B. | 17种 | C. | 18种 | D. | 19种 |
9.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备
BaCl2•2H2O的流程如下:

(1)写出“浸取”环节发生的主要反应的离子方程式:BaCO3+2H+═Ba2++CO2↑+H2O实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ad.
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图

①滤渣I中含Fe(OH)3(填化学式).再加入NaOH调节pH=12.5可除去Mg2+、Ca2+(填离子
符号).
②加入H2C204应避免过量的原因是H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少.
(3)25℃,H2C204和HF两种酸的电离平衡常数如下:
①HC2O4-的电离平衡常数表达式Ka2=$\frac{c({H}^{+})c({C}_{2}{{O}_{4}}^{2-})}{c(H{C}_{2}{{O}_{4}}^{2-})}$.
②H2C2O4溶液和NaF溶液反应的离子方程式为H2C2O4+F-═HF+HC2O4-.
BaCl2•2H2O的流程如下:

(1)写出“浸取”环节发生的主要反应的离子方程式:BaCO3+2H+═Ba2++CO2↑+H2O实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ad.
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图

①滤渣I中含Fe(OH)3(填化学式).再加入NaOH调节pH=12.5可除去Mg2+、Ca2+(填离子
符号).
②加入H2C204应避免过量的原因是H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少.
(3)25℃,H2C204和HF两种酸的电离平衡常数如下:
| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
②H2C2O4溶液和NaF溶液反应的离子方程式为H2C2O4+F-═HF+HC2O4-.
16.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 乙醇和水,乙醛和水,乙酸和乙醇 | |
| D. | 油脂和水,甲苯和水,乙醇和水 |
13.在由水电离的c(H+)=10-14 mol•L-1的溶液中,一定能大量共存的离子组是( )
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |

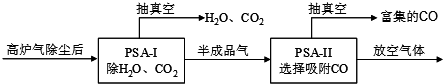
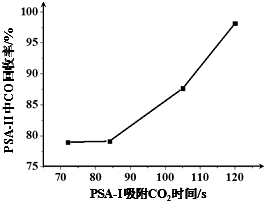
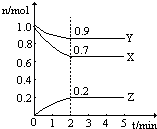 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: