题目内容
(10分)碘酸钾在酸性条件下是一种强氮化剂,与氢碘酸、二氧化硫等还原性物质反应时被还原为单质碘。碘酸钾在常温下稳定,但加热至560℃开始分解。工业生产碘酸钾的流程如下图所示。①中的反应为:6I2+11KC1O3+3H2O=6KH(IO3)2+5KC1+3C12
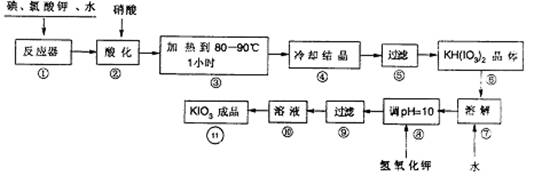
7-1.步骤②中,不能用HI的原因是:
7-2.有人认为①中由不碘单质制出了氯单质,说明碘单质的氧化性强于氯气,你认为是否正确?为什么?
7-3. 实验中涉及两次过滤,在实验室进行过滤时用到的玻璃仪器有:
7-4.步骤⑧用氢氧化钾调节溶液有pH,反应的化学方程式为:
7-5.碳酸钾的溶解度如下:
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
KIO3g/1100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
步骤11得到碘酸钠晶体,你的建议方法是:
1.HI具有还原性,能将已生成的碘酸氢钾还原。(2分)
2.不正确(1分)碘单质在本反应中作还原剂,没有表现氧化性,无法比较。(1分)
3.漏斗、浇杯、玻璃棒(共2分,少一个扣1分)
4.KH(IO3)2+KOH=2KIO3+H2O(2分)
5.蒸发冷缩、冷却结晶(2分)

 名校课堂系列答案
名校课堂系列答案
(1)步骤②中,用硝酸而不用HI的原因是____________________________________。
(2)有人认为①中碘单质制出了氯单质,说明碘的氧化性强于氯气,你认为是否正确?为什么?
(3)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有_______________。
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为___________________________。
(5)参照下表碘酸钾的溶解度,步骤![]() 得到碘酸钾晶体,你建议的方法是___________。
得到碘酸钾晶体,你建议的方法是___________。
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
KIO | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
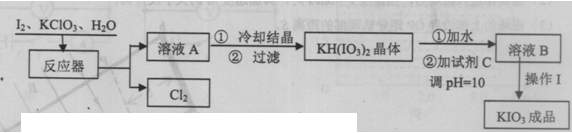

 2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。