题目内容
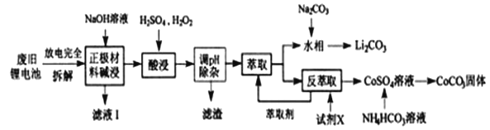
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是________不能用盐酸代替硫酸,原因是:__________。“调节pH”除去的离子主要有Al3+和_____。
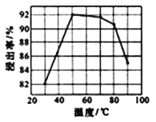
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是_________。
(4)“萃取”和“反萃取“可简单表示为:Co2++2(HA)2![]() Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为_________。
【答案】 NaA1O2、NaOH 将Co3+还原为Co2+ Co3+氧化C1-生成Cl2污染空气 Fe2+ 温度升高,H2O2分解速率加快,参与酸浸反应的H2O2的量减少,导致浸出率下降 H2SO4溶液 Co2++2HCO3-=CoCO3↓+CO2↑+H2O
【解析】(1).加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,所以滤液中为NaA1O2及过量的NaOH;
(2).由流程尾端可知要得到Co2+,所以H2O2所起主要作用是还原Co3+;盐酸中C1-有较强的还原性,能被氧化为Cl2,从而对空气造成污染,所以不能使用盐酸代替;由流程尾端可知铁离子已经在此步骤除去,且Al(OH)3和Fe(OH)3同样在水中溶解度较小;
(3). H2O2的分解为吸热反应,升高温度会促使H2O2分解速率加快,参与酸浸反应的H2O2的量减少,导致浸出率下降;
(4).反萃取需要提高氢离子浓度,根据生成硫酸钙物质,则X为硫酸;
(5).生成物中包含CoCO3,则反应方程式为:
CoSO4+2NH4HCO3=CoCO3↓+CO2↑+(NH4)2 SO4+H2O,则离子反应方程式为:Co2++2HCO3-=CoCO3↓+CO2↑+H2O

【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D