��Ŀ����
����Ŀ����֪����CH3OH(g)��![]() O2(g)===CO2(g)��2H2O(g)����H1=��a kJ��mol��1
O2(g)===CO2(g)��2H2O(g)����H1=��a kJ��mol��1
��CO(g)��![]() O2(g)===CO2(g)����H2=��b kJ��mol��1
O2(g)===CO2(g)����H2=��b kJ��mol��1
��H2(g)��![]() O2(g)===H2O(g)����H3=��c kJ��mol��1
O2(g)===H2O(g)����H3=��c kJ��mol��1
��H2(g)��![]() O2(g)===H2O(l)����H4=��d kJ��mol��1 ����������ȷ����
O2(g)===H2O(l)����H4=��d kJ��mol��1 ����������ȷ����
A. �������Ȼ�ѧ����ʽ��֪��H3<��H4
B. H2��ȼ����Ϊd kJ��mol��1
C. CH3OH(g)===CO(g)��2H2(g)����H=( a- b-2c)kJ��mol��1
D. ��CO��H2�����ʵ���֮��Ϊ1��2ʱ������ȫȼ������CO2��H2O(l)ʱ���ų�Q kJ��������������CO�����ʵ���Ϊ![]() mol
mol
���𰸡�B
��������A����̬ˮ��Һ̬ˮ�������ȣ�����d��c����H3����H4 ����A������ B��ȼ����Ӧ�����ȶ������Ӧ����Һ̬ˮ��ȼ����ΪdkJ��mol��1����B��ȷ��C�����ݸ�˹���ɣ�CH3OH(g)===CO(g)��2H2(g)���ɢ�����������2�õ���CH3OH(g)===CO(g)��2H2(g)����H=(b��2c��a)kJ��mol��1����C������D����CO��H2���ʵ����ֱ�Ϊn��2n����CO�ų���������nb�������ų���������2nd����nb��2nd=Q�����n= Q /(b��2d)mol����û������CO�����ʵ���ΪQ /(b��2d)mol����D����ѡB��

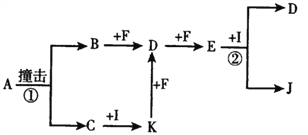
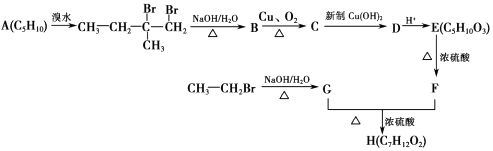
����Ŀ��ʵ���������������廯�ơ�����Ϊԭ���Ʊ����嶡��ķ�Ӧ���£� NaBr+H2SO4�THBr+NaHSO4
CH3CH2CH2CH2OH+HBr ![]() CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
��Բ����ƿ�м���ԭ�ϣ��������뼸����ʯ����װװ�â��������ڣ���ӦԼ40min������ӦҺ��ȴ��װΪװ�â������ֲ�Ʒ���������������б����£�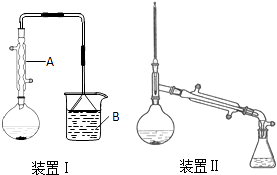
���� | ������ | ���嶡�� |
�е�/�� | 117.2 | 101.6 |
�۵�/�� | ��89.12 | ��112.4 |
�ܶ�/gcm��3 | 0.8098 | 1.2758 |
�ܽ��� | ����ˮ������Ũ���� | ������ˮ��Ũ���� |
�����ôֲ�Ʒ�����Һ©���У�����10mLˮϴ�ӣ���ȥ��ˮ�������ʣ�Ȼ��������5mLŨ���ᡢ10mLˮ��10mL����NaHCO3��Һ��10mLˮϴ�ӣ�������л��㣬������ˮ�Ȼ��ƹ��壬����1h�����˳�ȥ�Ȼ��ƣ��ٳ�ѹ�����ռ�99��103����֣�
�ش��������⣺
��1������A�������� �� ��ȴˮ��A������ϡ����¡�����ͨ�룮
��2����Բ����ƿ�м����ԭ���У���10mlˮ����7.5ml����������10g�廯�ƣ���12mLŨ���ᣮ�������ʵļ���˳���������������ȷ�𰸱�ţ��� a���٢ܢڢ�b���ܢ٢ڢ�c���ۢܢ٢�
��3���ձ�B��ʢ��NaOH��Һ�����յ�β����Ҫ�����ѧʽ������ʵ��ʹ�õ������м��ȣ��ܹ�ʹ�����Σ�
��4����Ũ����ϴ�Ӵֲ�Ʒʱ���л���ӷ�Һ©������Ͽڵ��������¿ڷų����������һ��ˮϴ��Ҫ��ϴ�� ��
��5���Ʊ����嶡��ʱ����ֱ����װ�â�߷�Ӧ�����������ԭ���� ��
��6����ʵ��õ����嶡��6.5g������Ϊ��ֻ��ʽ�����ؼ�����������
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060