��Ŀ����
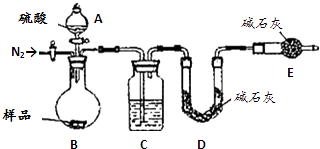
����Ŀ����ˮAlCl3���������������л��ϳɵĴ����ȣ���ҵ����������Al2O3��Fe2O3��Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������£�
��1���Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ ��
��2����Na2SO3��Һ�ɳ�ȥ��ȴ���ų�β���е�Cl2 �� �˷�Ӧ�����ӷ���ʽΪ �� �ڱ�״���£�����112L Cl2��ҪmolNa2SO3 ��
��3��Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ��������FeCl3���Ĵ��ȣ���ȡ��ˮAlCl3��Ʒ�����ڹ�����NaOH��Һ�����˳��������ϴ�ӡ����ա���ȴ�����أ���д���ⶨ��ˮAlCl3��Ʒ���ȵĹ������йط�Ӧ�����ӷ���ʽ�� �� ��
��4����ҵ����һ��������Ϊԭ���Ʊ���ˮAlCl3�����У����һ������AlCl36H2O��ȥ�ᾧˮ�Ʊ���ˮAlCl3 �� ʵ����һ���IJ��������� ��
��5����ҵ���������ᴿ���ұ������д����950��970���Na3AlF6�����½��е��������Ӧ�Ļ�ѧ����ʽ ��
��6���������м���Al����һ���������� ��
���𰸡�
��1��A12O3+3Cl2+3C ![]() 2A1Cl3+3CO
2A1Cl3+3CO
��2��SO32��+C12+H2O=SO42��+2C1��+2H+��5
��3��Fe3++3OH��=Fe��OH��3����Al3++4OH��=AlO2��+2H2O
��4���ڸ���HCl�����м���
��5��2A12O3![]() 4Al+3O2��
4Al+3O2��
��6��������FeCl3��ԭΪFe
���������⣺��1�����ݹ������̿�֪�Ȼ�¯�IJ������ȴ���������Ʊ���ˮAlCl3 �� ˵���Ȼ�¯�IJ����к���A1C13 �� ������β������CO������Al2O3��C12��C��Ӧ������A1C13��CO����Ӧ����ʽΪA12O3+3C12+3C ![]() 2A1C13+3CO�� ���Դ��ǣ�A12O3+3C12+3C
2A1C13+3CO�� ���Դ��ǣ�A12O3+3C12+3C ![]() 2A1C13+3CO����2��Cl2��ǿ�����ԣ���SO32������ΪSO42�� �� ��������ԭΪ2C1�� �� ��Ӧ���ӷ���ʽΪSO32��+Cl2+H2O�TSO42��+2Cl��+2H+ �� �ڱ�״���£�112L Cl2�����ʵ���Ϊ5mol�����ɷ���ʽ��֪Ӧ����5molNa2SO3 ��
2A1C13+3CO����2��Cl2��ǿ�����ԣ���SO32������ΪSO42�� �� ��������ԭΪ2C1�� �� ��Ӧ���ӷ���ʽΪSO32��+Cl2+H2O�TSO42��+2Cl��+2H+ �� �ڱ�״���£�112L Cl2�����ʵ���Ϊ5mol�����ɷ���ʽ��֪Ӧ����5molNa2SO3 ��
���Դ��ǣ�SO32��+Cl2+H2O=SO42��+2Cl��+2H+��5����3�����ӹ����������������������ӽ�ϳ��������������������������������ӽ�ϳ�ƫ�������ˮ�����ӷ���ʽΪFe3++3OH��=Fe��OH��3����Al3++4OH��=AlO2��+2H2O��
���Դ��ǣ�Fe3++3OH��=Fe��OH��3����Al3++4OH��=AlO2��+2H2O����4���Ȼ�����Һ����ˮ�⣬��AlCl36H2O��ˮ�Ʊ���ˮ�Ȼ�������HCl�����м����ѽᾧˮ�����Դ��ǣ��ڸ���HCl�����м��ȣ���5����������950��970���Na3AlF6�����½��е��������������������ʽΪ2A12O3![]() 4Al+3O2����
4Al+3O2����
���Դ��ǣ�2A12O3![]() 4Al+3O2������6����������AlĿ���dz�ȥFeCl3 �� ������FeCl3��ԭΪFe�����Դ��ǣ�������FeCl3��ԭΪFe��
4Al+3O2������6����������AlĿ���dz�ȥFeCl3 �� ������FeCl3��ԭΪFe�����Դ��ǣ�������FeCl3��ԭΪFe��