题目内容
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中正确的是( )
A.mA(s)+nB(g)![]() pC(g),平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动
pC(g),平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动
B.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),则CO2的体积分数不变可以作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变可以作为平衡判断的依据
C.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
D.对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
【答案】D
【解析】
A.mA(s)+nB(g)![]() pC(g),A为固体,平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数不变,正反应速率不变,平衡不移动,故A错误;
pC(g),A为固体,平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数不变,正反应速率不变,平衡不移动,故A错误;
B.生成物中氨气、二氧化碳的体积比始终为2:1,CO2的体积分数始终不变,不能作为平衡判断的依据,故B错误;
C.2NO(g)+2CO(g)=N2(g)+2CO2(g)由化学计量数可知△S<0,△H-T△S<0的反应可自发进行,在常温下能自发进行,则该反应的△H<0,故C错误;
D.该反应为气体体积不变的反应,平衡时A的体积分数为n%,此时若给体系加压,平衡不移动,则A的体积分数不变,故D正确;
故选D。

【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
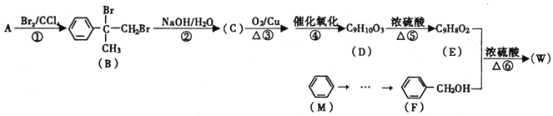
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
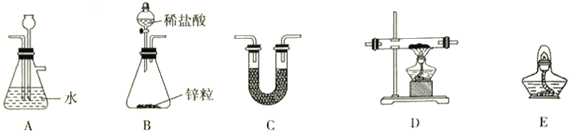
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
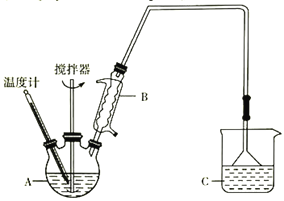
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
【题目】某学生用0.1200mol/LNaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是用序号字母填写:__→__→F→__→__→__→D。
(2)操作F中应该选择图中滴定管___填标号。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察__。
(4)滴定结果如表所示:
滴定次数 | 待测液体积 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为__(精确至0.001)。
(5)下列操作会导致测定结果偏高的是__。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
Ⅰ、写出用KMnO4滴定H2C2O4的离子方程式__。
Ⅱ、判断滴定终点的方法是__
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)__c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa;B.NaCN;C.Na2CO3,其pH由大到小的顺序是___(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__,溶液中![]() =__。(写出准确数值)
=__。(写出准确数值)
(2)某温度下,pH=3的盐酸中c(OH-)=10-9mol/L。该温度下,pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为__。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为__。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=___。
(4)已知Ksp(BaSO4)=1.1×10-10,其溶解度为___g。(保留2位有效数字)
(5)室温下,已知Ksp(Fe(OH)3)=1×10-38,当Fe3+完全沉淀时,其溶液的pH=___。