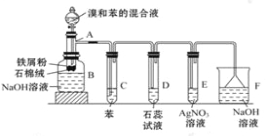
题目内容
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) ![]() x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
A. 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B. 平衡时,甲、乙两容器中A、B的物质的量之比相等
C. 平衡时,甲中A的体积分数为40%
D. 若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
【答案】C
【解析】本题考查化学反应平衡。在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)![]() xC(g) + D(s),向甲中通入6molA和2 molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,若平衡时,甲、乙两容器中A的物质的量不相等,则x=4,A不正确;平衡时,甲、乙两容器中A、B的物质的量之比相等(初始投入量和转化量均满足化学计量数之比),B不正确;此时测得甲、乙两容器中C的体积分数都为20%,平衡时A、B物质的量之比为3:1,则平衡时甲中A的体积分数为60%,C正确;若平衡时两容器中的压强不相等,则x=4,反应前后气体体积无变化,因此压强之比等于气体物质的量之比。
xC(g) + D(s),向甲中通入6molA和2 molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,若平衡时,甲、乙两容器中A的物质的量不相等,则x=4,A不正确;平衡时,甲、乙两容器中A、B的物质的量之比相等(初始投入量和转化量均满足化学计量数之比),B不正确;此时测得甲、乙两容器中C的体积分数都为20%,平衡时A、B物质的量之比为3:1,则平衡时甲中A的体积分数为60%,C正确;若平衡时两容器中的压强不相等,则x=4,反应前后气体体积无变化,因此压强之比等于气体物质的量之比。
甲中

乙中
通入1.5molA、0.5molB、3molC和2molD,

P甲/P乙=(6+2)/(1.5+0.5+3)=8/5,D不正确。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼。下列材料描述了一些常见金属的冶炼方法。
①工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁。
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气。
③湿法炼铜是工业上常用的一种炼铜的方法。使用铁和硫酸铜溶液反应。
④工业上冶炼银的方法是加热条件下让氧化银分解。
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰。
⑥相关各物质熔点见下表:
物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
Ⅰ根据上述信息回答下列问题:
(1)影响金属冶炼方法的首要因素是 。
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是 。
(3)写出铝热法冶炼锰的化学方程式 ,一般使用铝热法冶炼的金属具有哪些性质 。
Ⅱ下面是皮江法冶炼镁的工业流程示意图
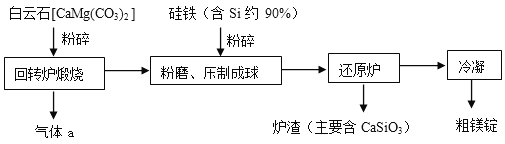
(1)气体a是 。
(2)白云石煅烧前粉碎的目的是 。
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有 、 。
(4)还原炉中抽空气到近似真空的原因是 。