题目内容
2.设阿伏加德罗常数的值为NA,则下列说法正确的是( )| A. | 常温常压下,18.0g NH4+中所含的质子数为10NA | |
| B. | 室温下,8g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 111g CaCl2晶体中所含共用电子对的数目为2NA |
分析 A、求出铵根离子的物质的量,然后根据1mol铵根离子中含11mol质子来分析;
B、求出甲烷的物质的量,然后根据1mol甲烷中含4mol共价键来分析;
C、常温下,铝在浓硫酸中会钝化;
D、CaCl2晶体为离子化合物,无共价键.
解答 解:A、18.0g铵根离子的物质的量为1mol,而1mol铵根离子中含11mol质子即11NA个,故A错误;
B、8g甲烷的物质的量为0.5mol,而1mol甲烷中含4mol共价键,故0.5mol甲烷中含2mol共价键即2NA个,故B正确;
C、常温下,铝在浓硫酸中会钝化,反应程度很小,即铝不能反应完全,故失去的电子数远小于0.3NA个,故C错误;
D、CaCl2晶体为离子化合物,结构中无共价键,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
12.除去如表各组物质中的少量杂质,所用方法正确的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | Cu | CuO | 在空气中灼烧 |
| B | CaO | Ca(OH)2 | 加入足量的稀盐酸 |
| C | H2 | CO | 通入O2,点燃 |
| D | O2 | H2O | 通过浓硫酸洗气 |
| A. | A | B. | B | C. | C | D. | D |
13.分子晶体中如果不是由于分子本身形状的影响,它的晶体将取密堆积结构,原因是分子晶体中( )
| A. | 分子间作用力无一定方向性 | B. | 占据晶格结点的微粒是原子 | ||
| C. | 化学键是共价键 | D. | 三者都是 |
17.有机化学与生活密切相关,下列有关说法不正确的是( )
| A. | 苯酚不慎粘在皮肤上可用酒精洗涤 | |
| B. | 福尔马林是混合物 | |
| C. | 工业酒精只能作实验室燃料 | |
| D. | 服用豆浆或鸡蛋清可以缓解铜离子中毒 |


 或
或 ;
;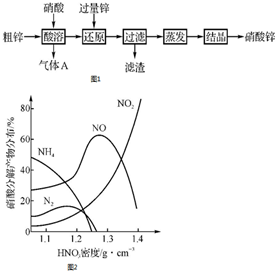 硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.
硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.