题目内容
12.下列说法不正确的是( )| A. | 氯气是既不是电解质,也不是非电解质,但其水溶液却可以导电 | |
| B. | Al2O3和MgO都是属于离子化合物,熔沸点都很高,故工业上常用熔点较低的AlCl3和MgCl2来冶炼金属 | |
| C. | H2O是分子晶体,晶体中含氢键,其熔沸点一般比同主族的氢化物要高 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
分析 A.单质既不是电解质也不是非电解质;
B.AlCl3为共价键化合物;
C.H2O分子间存在氢键;
D.分散质微粒直径:悬浊液>胶体>溶液.
解答 解:A.Cl2的水溶液能够导电是由于氯气和水反应生成HCl和HClO,二者都是电解质,但单质既不是电解质也不是非电解质,故A正确;
B.AlCl3为共价键化合物,不存在离子键,故B错误;
C.H2O分子间存在氢键,氢键能使物质的熔沸点升高,故C正确;
D.分散质微粒直径:悬浊液>胶体>溶液,故Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故D正确.
故选B.
点评 本题考查电解质、非电解的性质以及晶体类型、分散系等问题,题目难度中等,注意准确把握电解质、非电解质的概念,单质、混合物既不是电解质也不是非电解质.

练习册系列答案
相关题目
2.下列表示0.1mol/L NaHCO3溶液中有关微粒浓度(mol/L)的关系式中,正确的是( )
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| C. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | c(Na+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(H2CO3) |
3.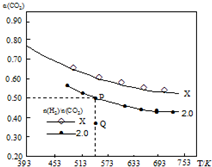 在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )
 在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 氢碳比:X<2.0 | |
| C. | 在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) | |
| D. | P点温度下,反应的平衡常数为512 |
20.下列药品与其作用相匹配的是( )
| A. | 医用碘酒:人体补碘 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 青霉素:解热镇痛 | D. | 氢氧化铝:中和过多胃酸 |
17.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
