题目内容
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示: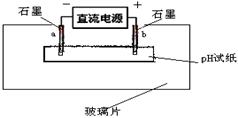
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
(1)HClO4(1分)
(2)S2-+H2O HS-+OH-(2分)
HS-+OH-(2分)
(3)产生淡黄色沉淀(1分) H2O2+H2S===S↓+2H2O(3分)
(4)Ba2++ 2OH- +2H+ + SO4 2- ="==" BaSO4↓+ 2H2O(3分)
(5)c(Na+)>c(ClO-)>c(OH-)>c(H+)(3分)
(6)试纸先变蓝,随后蓝色区域扩大,后被漂白褪色(2分)
解析

| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |



 如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )
如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )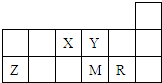 短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )