题目内容
14.下列说法正确的是( )| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na 和Cs 属于第IA 族元素,Cs 失电子能力比Na的强 | |
| D. | P 和As属于第VA 族元素,H3PO4酸性比H3AsO4的弱 |
分析 A、非金属性越强氢化物越稳定;
B、电子层结构相同时,核电数越多半径越小;
C、同主族元素,自上而下金属性增强;
D、非金属性越强最高价氧化物对应水化物的酸性越强.
解答 解:A、非金属性越强氢化物越稳定,而非金属性:Si<C,所以SiH4比CH4稳定差,故A错误;
B、电子层结构相同时,核电数越多半径越小,所以半径:O2->F-,故B错误;
C、同主族元素,自上而下金属性增强,原子失电子能力增强,所以Cs失电子能力比Na的强,故C正确;
D、非金属性越强最高价氧化物对应水化物的酸性越强,因非金属性:P>As,所以H3PO4酸性比H3AsO4的强,故D错误;
故选C.
点评 本题考查结构与位置关系、元素周期律、半径比较等,难度不大,掌握规律是解答的关键.

练习册系列答案
相关题目
12.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
| A. | 液氟的气化和液溴的气化 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
13.一种有机玻璃的结构简式为 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )
 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基-丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 等物质的量的有机玻璃和2-甲基-丙烯酸甲酯耗氧量相同 | |
| D. | 其在一定条件下发生水解反应时,可得到另外一种高分子化合物 |
2.(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是次外层电子数的一半,请回答下列问题:
(1)画出R的原子结构示意图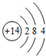 .
.
(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
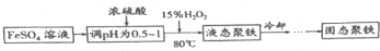
(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
| X | Y | Z | M |
| R | W |
 .
.(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:

(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
9.如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )
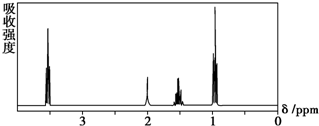

| A. | CH3CH2CH2CH3 | B. | (CH3)2CHCH3 | C. | CH3CH2CH2OH | D. | CH3CH2COOH |
19.已知去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )
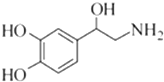

| A. | 去甲肾上腺素的分子式为C8H10O3N | |
| B. | 既能与FeCl3发生显色反应,也能和Na2CO3反应 | |
| C. | 1mol去甲肾上腺素最多能与2mol Br2发生取代反应 | |
| D. | 核磁共振氢谱显示应该有8种不同的氢原子. |
6.“环境问题”是当今全球共同关注的焦点,在哥本哈根气候大会上中国发挥了重要的作用.下列对环境造成危害的一组首要污染物是( )
| A. | CO2、SO2、O2 | B. | SO2、NO2、可吸入颗粒物 | ||
| C. | CO2、N2、O2 | D. | NO2、N2、可吸入颗粒物 |
3.下列物质不能由金属单质通过一步反应得到的是( )
| A. | Al(OH)3 | B. | Na[Al (OH)4] | C. | FeCl2 | D. | Na2O2 |
4.下列各组物质间,一定互为同系物的是( )
| A. | C2H6O和C4H10O | B. | C3H6O2和C4H8O2 | C. | C4H10和C10H22 | D. | C3H4和C4H6 |