题目内容
5.下列叙述正确的是( )| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
分析 A.同主族自上而下,元素非金属性减弱,氢化物稳定性减弱;
B.Li原子半径大于第三周期从Al开始向后的元素原子半径;
C.化学反应本质是旧键断裂、新键形成,一定伴随能量变化;
D.失去电子能力强弱与失去电子数目多少无关,与金属性有关.
解答 解:A.同主族自上而下,元素非金属性减弱,元素原子得电子能力逐渐减弱,氢化物稳定性减弱,故A错误;
B.Li原子半径大于第三周期从Al开始向后的元素原子半径,故B正确;
C.化学反应本质是旧键断裂、新键形成,一定伴随热量变化,故C正确;
D.失去电子能力强弱与失去电子数目多少无关,与金属性有关,如Ca失去电子能力比Na强,故D错误,
故选BC.
点评 本题考查元素周期律,难度不大,B为易错点,注意Cl原子半径在第二周期位置、Li原子半径在第三周期中位置.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.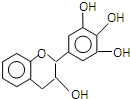 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 1 molEGC与足量溴水反应可消耗2 mol Br2 | |
| B. | EGC与苯酚属于同系物 | |
| C. | 在一定条件下,EGC中的羟基可被氯原子取代生成氯代烃 | |
| D. | 1mol EGC与含1.5mol Na2CO3的水溶液恰好完全反应生成1.5molCO2 |
13.下列有关化学与生活、工业的叙述中,不正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染. |
20.用式量是57的烃基取代甲苯苯环上的一个氢原子,能得到的有机物种数为( )
| A. | 4种 | B. | 8种 | C. | 12种 | D. | 24种 |
10.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如型l所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的c溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系如图2所示.请回答下列问题:
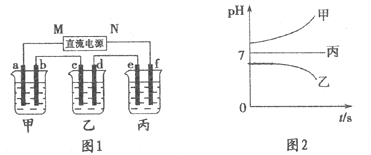
(1)M为直流电源的负极,b电极上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)计算e电极上生成的气体在标准状况下的体积为5.6L.
(3)写出乙烧杯中的总反应方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水.
(5)要使丙烧杯中的c溶液恢复到原来的状态,需要进行的操作是加入4.5gH2O.
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

(1)M为直流电源的负极,b电极上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)计算e电极上生成的气体在标准状况下的体积为5.6L.
(3)写出乙烧杯中的总反应方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水.
(5)要使丙烧杯中的c溶液恢复到原来的状态,需要进行的操作是加入4.5gH2O.
17.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
14.如图中表示外界条件(T、P)的变化对下列反应的影响L(s)+G(g)?2R(g);△H>0,y轴表示的是( )
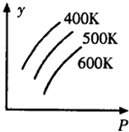

| A. | 平衡时,混合气体中R的百分含量 | B. | 平衡时,混合气中G的百分含量 | ||
| C. | G的转化率 | D. | L的转化率 |