题目内容
2SO2(g)+O2(g)
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=_______mol·L-1·min-1、v(SO3)=_______mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH_______(要求计算过程)。
(1)反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低
(2)-198
(3)SO2+V2O5====SO3+2VO2 4VO2+O2====2V2O5
(4)0.025 0.05
(5)S(s)+O2(g)====SO2(g) ΔH1=-296 kJ·mol-1①
SO2(g)+![]() O2(g)====SO3(g) ΔH2=-99 kJ·mol-1②
O2(g)====SO3(g) ΔH2=-99 kJ·mol-1②
①×3+②×3得
3S(s)+![]() O2(g)====3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1 185 kJ·mol-1
O2(g)====3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1 185 kJ·mol-1
解析:本题考查化学反应中的能量变化、盖斯定律、反应速率计算及催化剂的催化原理。(1)由图象知A、C点分别代表反应物、产物的总能量,E为反应的活化能,因反应历程不同而不同,但对反应热无影响;催化剂的加入,改变了反应历程,降低了反应的活化能,从而加快了反应速率。(2)由已知数据可知ΔH=-99 kJ·mol-1×2=-198 kJ·mol-1。(4)对于反应2SO2(g)+O2(g)![]() 2SO3(g),v(SO2)∶v(O2)∶v(SO3)=2∶1∶2,由v(SO2)=0.05 mol·L-1·min-1可得v(O2)和v(SO3)。(5)硫的燃烧热为296 kJ·mol-1,可得S(s)+O2(g)====SO2(g),ΔH=-296 kJ·mol-1,结合2SO2(g)+O2(g)
2SO3(g),v(SO2)∶v(O2)∶v(SO3)=2∶1∶2,由v(SO2)=0.05 mol·L-1·min-1可得v(O2)和v(SO3)。(5)硫的燃烧热为296 kJ·mol-1,可得S(s)+O2(g)====SO2(g),ΔH=-296 kJ·mol-1,结合2SO2(g)+O2(g)![]() 2SO3(g),ΔH=-198 kJ·mol-1,利用盖斯定律,即可求得由S(s)生成3 mol SO3(g)的ΔH。
2SO3(g),ΔH=-198 kJ·mol-1,利用盖斯定律,即可求得由S(s)生成3 mol SO3(g)的ΔH。

 阅读快车系列答案
阅读快车系列答案 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
 CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
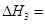 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
 (正)
(正) (逆) b.
(逆) b. 2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。