题目内容
1.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| C. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| D. | 由于W、Z元素的氢气化物还原性:W>Z |
分析 X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,据此解答.
解答 解:X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl.
A.X、M两种元素形成的化合物可以形成Na2O、Na2O2,故A错误;
B.硅晶体属于原子晶体,硫及氯气均形成分子晶体,故B错误;
C.Cl2和O3都具有强氧化性,则可以作为消毒剂,故C正确;
D.非金属性:Cl>S,元素的非金属性越强,对应的单质的氧化性越强,则对应氢化物还原性就越弱,故D错误,
故选C.
点评 本题考查位置结构性质的关系和应用,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
11.在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示.极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量.分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d•q.下列分子中μ=0的是( )
| A. | HCl | B. | CS2 | C. | H2S | D. | SO2 |
12.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率为0.8mol•L-1•s-1,是指在1s时某物质的浓度是0.8mol•L-1 | |
| B. | 化学反应速率是指在一段时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 | |
| C. | 化学反应速率可以衡量化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象越明显 |
9.如图1所示装置实验,若图2中X 轴表示流入阴极的电子的物质的量,则Y 轴可表示( )
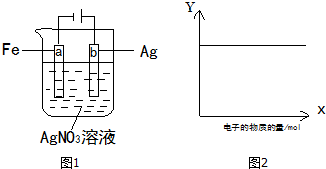
①c(Ag+) ②a棒的质量 ③c(NO3-) ④b棒的质量 ⑤溶液的pH.

①c(Ag+) ②a棒的质量 ③c(NO3-) ④b棒的质量 ⑤溶液的pH.
| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
16.将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应:
①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 3.2 | B. | 0.2 | C. | $\frac{1}{180}$ | D. | $\frac{4}{45}$ |
6.25℃时,几种弱酸的电离常数如表:25℃时,下列说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
13.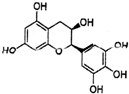 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子式为C15H13O7 | |
| B. | EGC可在强碱的醇溶液中发生消去反应 | |
| C. | 1molEGC最多消耗6molNaOH | |
| D. | 1molEGC加入溴水中,可与4molBr2发生取代反应 |
10.两种元素可以组成AB2型离子化合物,它们的原子序数是( )
| A. | 6和8 | B. | 20和17 | C. | 1和8 | D. | 13和8 |
11.金属钾晶体(如图)的结构的叙述中正确的是( )
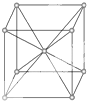

| A. | 是密置层的一种堆积方式 | B. | 晶胞是六棱柱 | ||
| C. | 每个晶胞内含2个原子 | D. | 每个晶胞内含6个原子 |