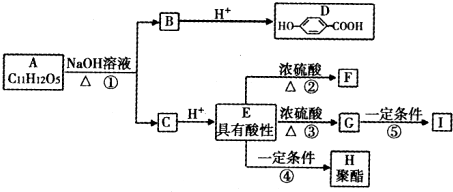
题目内容
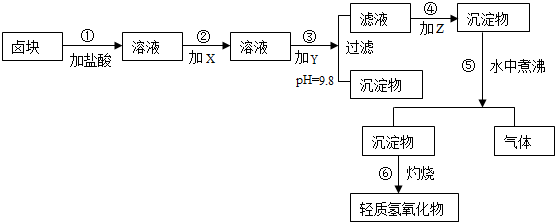
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),以它为原料,按如下工艺流程图,可制得“轻质氧化镁”. 如果要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定.
表一:生成氢氧化物沉淀的pH 表二:化学试剂价格表
(注)Fe(OH)2呈絮状,不易从溶液中除去,除Fe2+通常将它氧化成为Fe3+后,生成Fe(OH)3而除之.
请填写以下空白:
(1)在步骤②中加入的试剂X,最佳选择应是 简述原因: ;试剂X的作用是 .
(2)在步骤③中加入的试剂应是 ,控制pH=9.8的目的是 .
(3)有同学提出控制pH=9.6更为合适,你认为是否正确 (填正确、不正确)并说明理由: .

表一:生成氢氧化物沉淀的pH 表二:化学试剂价格表
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含NaClO25.2%) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | H2O2(30%) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | NaOH(固98%) | 2100 | |
| Mg(OH)2 | 9.6 | 11.1 | Na2CO3(固95%) | 600 | |
| 卤块(MgCl2,30%) | 310 |
请填写以下空白:
(1)在步骤②中加入的试剂X,最佳选择应是
(2)在步骤③中加入的试剂应是
(3)有同学提出控制pH=9.6更为合适,你认为是否正确
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),以它为原料,按如下工艺流程图,可制得“轻质氧化镁”;加入盐酸溶解得到溶液中含Mg2+、Fe2+、Fe3+、Mn2+等离子,加入氧化剂氧化亚铁离子为铁离子,依据化学试剂价格选择经济效益低的漂液作为氧化剂X,要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定;加入Y为镁的氧化物调节溶液pH=9.8使铁离子、锰离子全部沉淀,过滤得到滤液为氯化镁溶液,加入碳酸钠溶液沉淀镁离子,水中煮沸得到氢氧化镁和二氧化碳,氢氧化镁灼烧得到氧化镁.
解答:
解:“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),以它为原料,按如下工艺流程图,可制得“轻质氧化镁”;加入盐酸溶解得到溶液中含Mg2+、Fe2+、Fe3+、Mn2+等离子,加入氧化剂氧化亚铁离子为铁离子,依据化学试剂价格选择经济效益低的漂液作为氧化剂X,要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定;加入Y为镁的氧化物调节溶液pH=9.8使铁离子、锰离子全部沉淀,过滤得到滤液为氯化镁溶液,加入碳酸钠溶液沉淀镁离子,水中煮沸得到氢氧化镁和二氧化碳,氢氧化镁灼烧得到氧化镁;
(1)在步骤②中加入的试剂X,要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定,最佳选择应是漂液(NaClO),试剂X的作用是漂液(NaClO)和H2O2都能使Fe2+氧化为Fe3+;
故答案为:漂液(NaClO);漂液(NaClO)和H2O2都能使Fe2+氧化为Fe3+,但漂液(NaClO)的成本比H2O2低很多;使Fe2+氧化为Fe3+;
(2)在步骤③中加入的试剂,依据化学试剂的价格分析判断应是NaOH,使Fe2+、Fe3+、Mn2+等杂质离子都能生成氢氧化物沉淀以便过滤除去;
故答案为:NaOH;使Fe2+、Fe3+、Mn2+等杂质离子都能生成氢氧化物沉淀以便过滤除去;
(3)由表中数据可知,pH=9.8时Mg2+也部分生成Mg(OH)2,影响产率,但因卤块价格便宜,多沉淀一点镁离子可行;控制pH=9.6,锰离子不能全部沉淀;
故答案为:不正确;由表中数据可知,pH=9.8时Mg2+也部分生成Mg(OH)2,影响产率,但因卤块价格便宜,损失一些以保证产品(MgO)的纯度,是可行的.
(1)在步骤②中加入的试剂X,要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定,最佳选择应是漂液(NaClO),试剂X的作用是漂液(NaClO)和H2O2都能使Fe2+氧化为Fe3+;
故答案为:漂液(NaClO);漂液(NaClO)和H2O2都能使Fe2+氧化为Fe3+,但漂液(NaClO)的成本比H2O2低很多;使Fe2+氧化为Fe3+;
(2)在步骤③中加入的试剂,依据化学试剂的价格分析判断应是NaOH,使Fe2+、Fe3+、Mn2+等杂质离子都能生成氢氧化物沉淀以便过滤除去;
故答案为:NaOH;使Fe2+、Fe3+、Mn2+等杂质离子都能生成氢氧化物沉淀以便过滤除去;
(3)由表中数据可知,pH=9.8时Mg2+也部分生成Mg(OH)2,影响产率,但因卤块价格便宜,多沉淀一点镁离子可行;控制pH=9.6,锰离子不能全部沉淀;
故答案为:不正确;由表中数据可知,pH=9.8时Mg2+也部分生成Mg(OH)2,影响产率,但因卤块价格便宜,损失一些以保证产品(MgO)的纯度,是可行的.
点评:本题考查了物质分离提纯的实验方法和流程分析判断,主要是物质性质的理解应用,题目难度中等.

练习册系列答案
相关题目
下列反应类型中,一定没有发生电子转移的是( )
| A、复分解反应 | B、置换反应 |
| C、分解反应 | D、化合反应 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 |
| C、水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
| D、Li是最轻的金属,也是活动性强的金属,是制造电池的理想物质 |
下列图示与对应叙述相符合的是( )
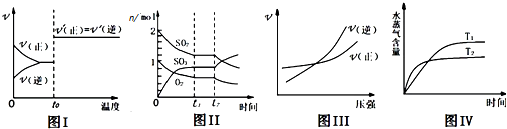

| A、图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B、图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C、图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D、图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
下列说法正确的是( )
| A、分子晶体中一定存在分子间作用力,不一定存在共价键 |
| B、分子中含两个氢原子的酸一定是二元酸 |
| C、非极性分子中一定含有非极性键 |
| D、元素的非金属性越强,其单质的活泼性一定越强 |