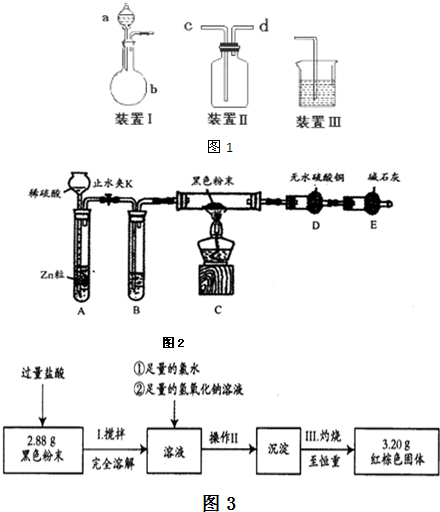
题目内容
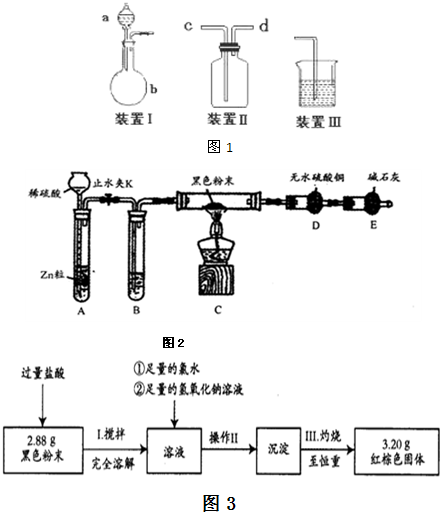
 某活动小组利用如图进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕).
某活动小组利用如图进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕).
I.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作:______.
(2)从导管a通入一定量的NO,并测得NO体积为VL(V<50ml,气体体积已经换算为标准状况).准确测得NO体积的主要操作______.
II.验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是______.写出对应现象的化学方程式______.
(2)继续通入O2,打开K3,并及时调整酸式滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体.
①当通入氧气的体积为 时,则广口瓶①的气体体积为______;
时,则广口瓶①的气体体积为______;
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为______mol/L.
故答案为:打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排除,且调整滴定管中液面与①相平,并记录滴定管的刻度.
(2)广口瓶①中压强均与外界相同,通过调节两端液面,到两端高度相同时再读取体积.具体操作为:关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
故答案为:关闭K2,打开K3,K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管刻度.
II.(1)NO易与氧气反应2NO+O2═2NO2 生成红棕色的NO2,NO2又与水反应3NO2+H2O═2HNO3+NO,颜色变浅.
故答案为:气体先变为红棕色然后逐渐变淡;2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;
(2)①令NO的体积为VL,由4NO+3O2+2H2O═4HNO3可知,VLNO 完全反应需 O2
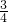 VL,
VL,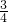 VL>
VL> VL,所以,氧气不足,NO有剩余,根据氧气计算,由4NO+3O2+2H2O═4HNO3可知,参加反应的NO为
VL,所以,氧气不足,NO有剩余,根据氧气计算,由4NO+3O2+2H2O═4HNO3可知,参加反应的NO为 VL×
VL× =
=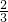 VL,所以剩余的NO未VL-
VL,所以剩余的NO未VL-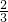 VL=
VL= VL.
VL.故答案为:
 VL
VL②溶液为硝酸溶液,由4NO+3O2+2H2O═4HNO3可知,n(HNO3)=n(NO)=
 =
= mol,
mol,所以,c(HNO3)=
 =
= =
= mol/L.
mol/L.故答案为:
 mol/L.
mol/L.分析:I.(1)NO易与氧气反应,通过测量所排出液体的体积从而得到气体体积,广口瓶①中应充满水;
(2)广口瓶①中压强均与外界相同,通过调节两端液面,到两端高度相同时再读取体积;
II.(1)NO易与氧气反应生成红棕色的NO2,NO2又与水反应;
(2)①根据反应方程式4NO+3O2+2H2O═4HNO3过量计算;
②通入的氧气与NO按4NO+3O2+2H2O═4HNO3恰好完全反应,为硝酸溶液,溶液的体积为500ml,求出硝酸的物质的量,利用c=
 计算.
计算.点评:关键是准确读取液面,为了较准确地测量气体的体积,读数应在保证内外气压相等的条件下,通过调节两端液面,到两端高度相同时再读取体积.

某化学课外活动小组在实验室做了如下一系列实验:
(1)该小组设计了如图所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能
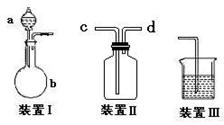 性。
性。
① 甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加
入 或 ,装置Ⅱ从 管口进气即可作为O2的收集装置。
 ② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
(2)小组在整理实验室的化学试剂时,发现一盛有
无色溶液的试剂瓶。标签破损(如图),请你根
据已掌握的知识,对该试剂可能是什么物质的溶
液作出二种猜想,并设计实验验证,写出任一种
的实验操作、现象和结论。
| 猜想物质的化学式 | 检验所需要的试剂 | 操作、现象和结论 | |
| ① | |||
| ② |
|
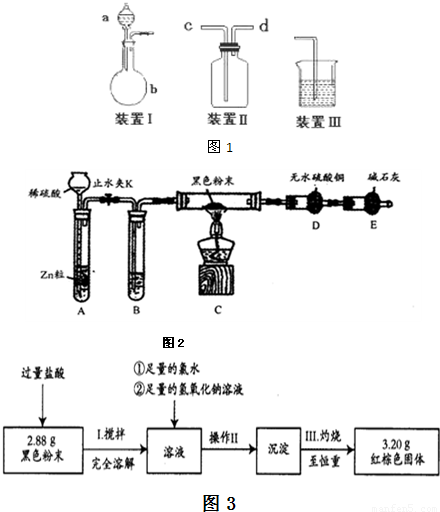
(3)该小组从ZnSO4、FeCl3的混合溶液中制取ZnSO4?7H2O过程如下:
a.在混合液中加入6 mol?L―1NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol?L―1的硫酸,保持溶液的pH在4~6,加热煮沸,
趁热过滤,滤液即为ZnSO4溶液
d.滤液中注入2 mol?L―1的硫酸,使其pH保持为2……
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列
问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
① 步骤a中用pH试纸控制溶液pH=8,使用pH试纸的操作是 ;步骤b中如何
检验沉淀已经洗涤干净? 。
② 要制得ZnSO4?7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐
仪器是 。