题目内容
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
A.CaCO3(s)B.KNO3溶液
C.Na2SO4溶液D.CuSO4(s)
【答案】C
【解析】
A.CaCO3(s)与盐酸反应,使盐酸的浓度减小,反应速率减慢,产生的氢气量减少,故A不选;
B.KNO3溶液与盐酸混合后,硝酸根离子在酸性条件下氧化性强于盐酸,硝酸与铁反应不产生氢气,故B不选;
C.Na2SO4溶液与盐酸不反应,且将盐酸浓度冲稀,浓度减小,速率变慢,故C选;
D.CuSO4(s)中铜离子的氧化性比氢离子强,铁先置换出铜,形成原电池,加快反应速率,故D不选;
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
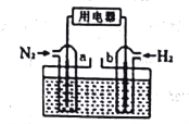
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。