题目内容
【题目】800 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/mol | 0.60 | 0.20 |
(1)反应在2 min内的平均速率为v(H2O)=________。
(2)800 ℃时,化学平衡常数K的值为________。
(3)保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率________(填“增大”、“减小”或“不变”)。
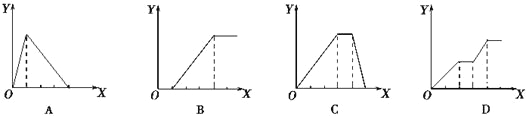
(4)在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。

【答案】
(1)0.075 mol·L-1·min-1
(2)1
(3)增大
(4)
【解析】
试题分析:①根据v=△c/t可知,CO的反应速率为(1.2-0.9)/(2×2)molL-1min-1=0.075 molL-1min-1,利用速率之比等于计量数之比可知水的速率为0.075 molL-1min-1。
故答案为:0.075 molL-1min-1;
②在4分钟时,水的变化的物质的量为0.4mol,根据化学方程式可知,CO的变化的物质的量也为0.4mol,
所以4min时CO的物质的量为1.2mol-0.4mol=0.8mol,而6min时也是0.8mol,所以反应在4min时达到平衡,
CO(g)+H2O(g)H2(g)+CO2(g),
起始(mol/L) 0.6 0.3 0 0
转化(mol/L) 0.2 0.2 0.2 0.2
平衡(mol/L) 0.4 0.1 0.2 0.2
平衡常数为K=![]() =1。
=1。
故答案为:1;
③根据影响平衡移动的条件可知,增加一种反应物浓度可以提高另一种反应物的转化率。
故答案为:增大;
④由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此画出图为 。
。
故答案为: 。
。