题目内容
(2013?保定一模)RO2受热分解为+4和+2价的混合氧化物,-4价的R能氧化浓盐酸生成Cl2,现 将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O3和Cl2物质的量之比为3:2,则残余固体的组成及物质的量之比可能是( )
分析:RO2受热分解得到氧气和铅的氧化物的混合物(R为+4、+2价),该混合物再与盐酸作用时,+4价R还原为+2价,Cl-被氧化为Cl2,此时得到溶液为RCl2溶液,利用“电子转移守恒”知1molRO2在上述转化过程中共转移2mole-,设该过程得到O2的物质的量为3xmol,则Cl2的物质的量为2xmol,利用电子转移守恒计算x的值,进而确定PbO2加热分解后的物质中n(R):n(O),据此判断.
解答:解:RO2受热分解得到氧气和铅的氧化物的混合物(R为+4、+2价),该混合物再与盐酸作用时,+4价R还原为+2价,Cl-被氧化为Cl2,此时得到溶液为RCl2溶液,利用“电子转移守恒”知1molRO2在上述转化过程中共转移电子为1mol×(4-2)=2mol,
设该过程得到O2的物质的量为3xmol,
则Cl2的物质的量为2xmol,
利用电子转移守恒有:3x×4+2x×2=2,
解得x=0.125,
故1mol RO2在受热分解过程中产生O2为0.125mol×3=0.375mol,
利用原子守恒可知受热后的剩余固体中n(O)=2mol-0.375mol×2=1.25mol,
所以剩余固体中n(R):n(O)=1mol:1.25mol=4:5,
A.当R3O4与RO的物质的量之比为2:1,则n(R):n(O)=(3×2+1):(4×2+1)=7:9,故A错误;
B.当RO2和RO的物质的量之比为1:3,则n(R):n(O)=(1+1×3):(1×2+1×3)=4:5,故B正确;
C.当RO2和R3O4 的物质的量之比为1:2,则n(R):n(O)=(1+2×3):(1×2+2×4)=7:10,故C错误;
D.当RO2和R0的物质的量之比为1:4,则n(R):n(O)=(1+4):(1×2+1×4)=1:2,故D错误;
故选B.
设该过程得到O2的物质的量为3xmol,
则Cl2的物质的量为2xmol,
利用电子转移守恒有:3x×4+2x×2=2,
解得x=0.125,
故1mol RO2在受热分解过程中产生O2为0.125mol×3=0.375mol,
利用原子守恒可知受热后的剩余固体中n(O)=2mol-0.375mol×2=1.25mol,
所以剩余固体中n(R):n(O)=1mol:1.25mol=4:5,
A.当R3O4与RO的物质的量之比为2:1,则n(R):n(O)=(3×2+1):(4×2+1)=7:9,故A错误;
B.当RO2和RO的物质的量之比为1:3,则n(R):n(O)=(1+1×3):(1×2+1×3)=4:5,故B正确;
C.当RO2和R3O4 的物质的量之比为1:2,则n(R):n(O)=(1+2×3):(1×2+2×4)=7:10,故C错误;
D.当RO2和R0的物质的量之比为1:4,则n(R):n(O)=(1+4):(1×2+1×4)=1:2,故D错误;
故选B.
点评:本题考查了氧化还原反应的计算,计算转移电子守恒计算R、O元素的物质的量,再结合原子守恒来分析解答,难度中等.

练习册系列答案
相关题目
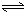 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O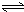 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O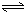 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O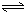 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全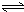 Cr2O72-+H2O
Cr2O72-+H2O