题目内容
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O]是一种重要的还原剂,在空气中比一般的 亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
回答下列问题:
Ⅰ.制取莫尔盐
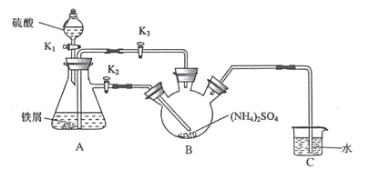
(1)连接装置,检査装置气密性。将 0.1mol(NH4)2SO4晶体置于玻璃仪器中 __填仪器 名称),将 6.0g 洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞 K3,打开 K2、K1,加完 55.0mL2mol·L-1 稀硫酸后关闭K1。
②待大部分铁粉溶解后,打开 K3、关闭 K2,此时可以看到的现象为__________;原因是____________。
③关闭活塞 K2、K3,采用 100℃水浴蒸发 B中水分,液面产生晶膜时,停止加热,冷却结晶、_______________、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的 pH 在 1~2 之间, 其目的为_______________。
④装置 C 的作用为 _____,装置 C 存在的缺点是_____。
Ⅱ.测定莫尔盐样品的纯度:取mg该样品配制成 1L 溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。
(1)已知:Cr2O72-还原产物为Cr3+,写出此反应的离子方程式_____。
(2)滴定时必须选用的仪器是_____。
①![]() ②
②![]() ③
③![]() ④
④ ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]()
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。[(NH4)2Fe(SO4)26H2O,Mr=392,BaSO4,Mr=233]
待测液→足量的 BaCl2 溶液→过滤→洗涤→干燥→称量→wg 固体
(3)莫尔盐晶体纯度为_____(用含 m、w 的式子表示,不用算出结果)。
(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_____。
【答案】三颈烧瓶 A中的液体被压入B中 A中产生氢气,使A中压强增大 过滤 抑制Fe2+ 水解 液封作用,防止空气进入三颈烧瓶氧化Fe2+ 不能除去尾气中的H2或答可能会倒吸均可 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O ①④⑥ ![]() 部分
部分![]() 被空气氧化
被空气氧化
【解析】
制取莫尔盐:打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2molL-1稀硫酸,硫酸和铁反应生成氢气,将装置内的空气排出,待大部分铁粉溶解后,打开K3、关闭K2,A中的液体被压入B中,关闭活塞K2、K3,采用100℃水浴蒸发B中水分,可生成莫尔盐,冷却结晶,过滤,用无水乙醇洗涤,可得到莫尔盐晶体,装置C可用于液封,防止空气进入三颈烧瓶氧化Fe2+。据此解答。
Ⅰ.(1)根据装置的结构特点可知装置为三颈烧瓶;
(2)②待大部分铁粉溶解后,打开K3、关闭K2,A中生成氢气,压强增大,可将A中的液体压入B中;
③将晶体从溶液中分离出来,可用过滤的方法;硫酸过量,可抑制亚铁离子水解;
④导管插入液面以下,可起到液封作用,防止空气进入三颈烧瓶氧化Fe2+的作用,但不能除去尾气中的H2,甚至发生倒吸;
Ⅱ.(1)Cr2O72-还原产物为Cr3+,摩尔盐中亚铁离子被氧化生成铁离子,同时还生成水,根据反应物和生成物结合电子守恒和元素守恒可得离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(2)酸性K2Cr2O7溶液具有强氧化性和酸性,应该盛放在酸式滴定管中,所以该实验滴定时需要的仪器有酸式滴定管、滴定管夹、锥形瓶,所以应该选取①④⑥;
(3)得到的沉淀是BaSO4,n(BaSO4)=![]() =
=![]() mol,根据硫酸根离子守恒得(NH4)2Fe(SO4)26H2O~2BaSO4,则n[(NH4)2Fe(SO4)26H2O]=
mol,根据硫酸根离子守恒得(NH4)2Fe(SO4)26H2O~2BaSO4,则n[(NH4)2Fe(SO4)26H2O]=![]() n(BaSO4)=
n(BaSO4)=![]() mol,m[(NH4)2Fe(SO4)26H2O]=
mol,m[(NH4)2Fe(SO4)26H2O]= ![]() mol×392g/mol×
mol×392g/mol×![]() =
=![]() g,摩尔盐纯度=
g,摩尔盐纯度=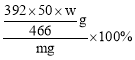 =
=![]() 。
。
(4)Fe2+不稳定,易被空气氧化,会导致方法一测定值偏小。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案